遗传性视网膜病变基因治疗药物研究
 治疗领域:遗传性视网膜病变
治疗领域:遗传性视网膜病变
目前全球遗传性视网膜疾病患者约300万,其中因此致盲的人数约有150万,约占总人口的0.02 %。遗传性视网膜病变(inherited retinal diseases,IRDs)种类众多,主要包括非综合征性视网膜色素变性(40 %)、Usher综合征(10 %)、锥一杆细胞营养不良(10 %)、Leber先天性黑朦(5 %)、Leber遗传性视神经病变及各大类亚型等。遗传模式上,遗传性视网膜病变表现为常染色体显性、常染色体隐性、X-连锁和线粒体母系遗传,迄今为止已发现超过200个致病基因。
其中IRDs是儿童和工作年龄人群中致盲的最主要病因(发病率高达1/1000),目前无有效治疗方法。近年来,基因治疗IRDs取得了令人瞩目的成绩,RPE65基因治疗药物(商品名Luxturna,美国Spark公司)2017.12.20 获得美国FDA批准上市。
基因治疗之所以在IRDs上取得较好效果与眼球解剖结构有直接关系。
(1)眼球屈光间质透明,有利于在可视状态下准确注射载体;
(2)眼球在解剖上相对封闭,转基因载体只转染到眼球特定的靶细胞,很少播散到身体其他部位;
(3)视网膜下腔具有高度的免疫赦免,注射后基本不会引起免疫反应。
因此,与其它器官相比,眼球的解剖结构,尤其适合基因治疗。
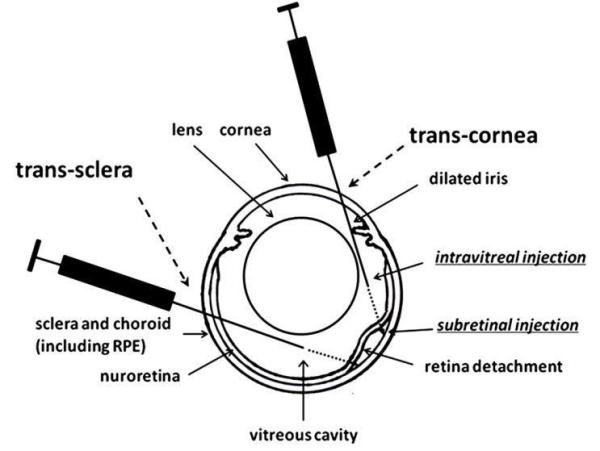
遗传性视网膜病变基因治疗 示意图
02
临床需求:缺医少药
遗传性视网膜疾病是当前威胁儿童和青少年最主要的致盲性眼病,目前尚没有特效的治疗方法,对国家、社会和家庭都是沉重的负担。IRDs西方国家内的发病率为1/3784~1/4000,据此推算,西方国家大约有150万的IRDs患者。中国IRDs的发病率为1/1000,据此推算中国有140万IRDs患者。针对这一类疾病,目前没有其它有效治疗方法,基因治疗是唯一的希望。且其是在分子层面一次性解决问题,可能无需像传统治疗方案一样持续用药。但是进口基因治疗药物价格昂贵,国产药物刚性需求强。
基因疗法先锋Spark公司产品Luxturna是唯一获批的眼科基因治疗药物。Luxturna是首次用AAV运输的基因疗法,用于治疗RPE65基因突变导致的视网膜变性患者。RPE65 突变可导致患者视力丧失,在某些患者中可能引起完全失明。此疗法用AAV将健康的RPE65基因引入患者体内,让患者生成正常功能的蛋白来改善视力,用于治疗RPE65基因突变引起的眼疾。
03
治疗手段:基因替代、基因编辑
基因治疗,在早期是指用正常的基因整合人细胞基因组以校正或置换致病基因的治疗方法。随着人们对疾病本质与分子生物学方法的不断更新,其涵义得以扩展,目前广义上讲,将某种遗传物质转移到患者体内发挥作用,以达到治疗疾病的目的,均称为基因治疗。基因治疗的方法技术基本上分为以下几种:①基因替代,②基因沉默,③基因编辑。目前,用于眼科IRDs的基因治疗方法主要有基因替代疗法和基因编辑疗法。
3.1基因替代
重组腺相关病毒(rAAV)是一种常用病毒表达系统。rAAV的基因组及其携带的外源基因不整合入宿主细胞基因组中,而是游离于宿主基因组之外独立表达,因此可实现目的基因瞬时、高丰度表达,同时还避免因整合而引发的、潜在的基因突变和随机效应,安全性和可控性高。
rAAV基因治疗过程分如下步骤:(1)把目的基因片段插入rAAV基因组中;(2)重组后的rAAV体外包装生产和纯化;(3)将rAAV注射到视网膜下腔;(4)rAAV感染病变细胞,将正常基因带入靶细胞;(5)靶细胞表达正常基因合成功能正常的蛋白质,实现疾病缓解。
从原理和操作流程上看,基因治疗并不复杂,但在实际操作中仍有诸多难题需克服,眼科的特殊性降低了其难度:
(1)定点注射到达靶细胞且维持病毒浓度保证侵染效率;
(2)眼球免疫豁免使病毒载体免受免疫系统攻击;
(3)眼球面积小,容易达到相应病毒数量。

基因替代治疗 示意图
3.2 基因编辑
基因编辑是一组用来修改细胞或生物体基因组的技术,利用核酸内切酶在基因组上特定位置产生双链断裂,通过内源性DNA修复过程对断裂点进行修复,在其修复过程中可以对基因组进行点突变、缺失及插入等改造以获得理想的基因型。与第一代人工核酸内切酶ZFN和第二代人工核酸内切酶TALEN相比,CRISPR/Cas9因靶点设计简单、操作简便、费用低廉和编辑效率高等优势,广泛应用于细胞系改造、疾病动物模型建立和基因治疗等领域。
目前,应用CRISPR/Cas9技术实现目的基因定点编辑的方法主要有:同源重组 (Homologous Recombination, HR)、非同源末端连接 (Non-homologous End Joining, NHEJ)、微同源臂介导的靶向整合 (Microhomology-mediated end joining, MMEJ)、非同源依赖性靶向整合 (Homology independent targeted integration, HITI)、单碱基编辑 (Base editing) 及同源臂介导的末端接合 (Homology-mediated end-joining, HMEJ) 等,其中HMEJ拥有相对高的编辑效率和更好的精确度。
基因编辑治疗不仅可实现DNA水平有效而持久的修复,而且因保留了基因内含子区和内源调控序列,与替代治疗相比是一种更有前途的治疗方法。
3.3 基因替代与基因编辑比较
基因替代:
适应症:常染色体隐性或X-连锁隐性遗传IRDs;
优势:转录后调节,不插入基因组,安全、毒副作用小,效果持久;
劣势:rAAV包载容量限制,大的基因装不进;某些基因单纯替代治疗效果有限;
临床应用:RPE65基因替代治疗药物上市(Luxturna);国际上超过10项临床试验正在进行;
国内现状:中因科技、纽福斯目前在临床前阶段,计划申报临床实验。
基因编辑:
适应症:常染色体显性、隐性或X-连锁遗传IRDs;大片段缺失(>1KB)突变不适用;
优势:插入基因组,DNA水平修正;
劣势:脱靶效应(眼球病灶局限、剂量小);免疫反应(眼球具有免疫赦免);全身毒性(眼球封闭,不会扩散);
临床应用:Editas公司2019年夏将开展首次临床实验(CEP290基因所致IRDs);
国内现状:中因科技目前在临床前实验阶段,计划申报临床实验。
04
研究现状
基因疗法先锋Spark公司产品Luxturna是唯一获批的遗传性视网膜变性基因治疗药物。目前国内外眼科基因治疗研究公司,适应症,产品以及融资阶段见下表:
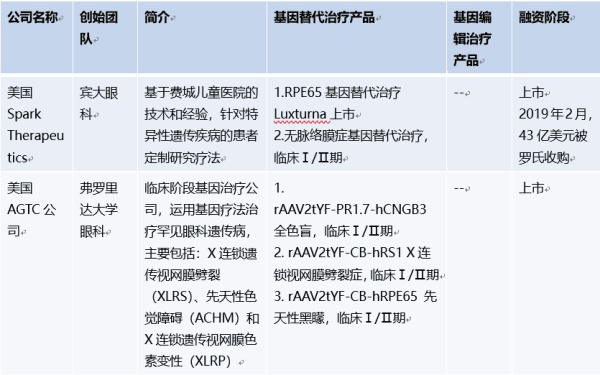


4.1代表药物
Spark Luxturna
适应症 用于治疗因双拷贝RPE65基因突变所致视力丧失但保留有足够数量的存活视网膜细胞的儿童和成人患者,恢复和改善视力
价格 85 万美元
05
研发重点
5.1 靶标筛选
国内发病率前30位的眼科单基因有CYP4V2、USH2A、ABCA4、RPGR等。
基因替代治疗:根据.clinicaltrials的临床统计数据分析,替代治疗上,国际研究和关注热点集中在RPE65、RPGR和CHM等有限的几个基因。
国际国内特点:国际研究起步早,已经形成点状研究热点,但未形成线状或者面状布局,出现少量机会点。中因根据机会点进行替代治疗上的管线设计和知识产权布局,考虑有第一梯队,第二梯队,第三梯队基因药物研发项目。
基因编辑治疗:国际国内特点:国际国内起步都晚,加上编辑治疗比替代治疗在方法上和位点上要丰富,因此机会点非常丰富。
5.2 病毒包装
完善的AAV病毒生产纯化体系(采用贴壁培养HEK-293T细胞和PEI细胞转染法生产AAV病毒,此法优势在于PEI转染试剂价格低廉、基本无细胞毒性、转染效率极高(>99%);采用PEG8000/氯仿萃取纯化工艺,可以快速纯化出纯度较高的各种血清型AAV病毒,此方法优势在于纯化步骤少、速度快、纯度高、不依赖血清型。
5.3 质量研究
在AAV病毒质控方面,对无菌检测、支原体检测、衣原体检测、内毒素检测、复制性AAV病毒污染(rcAAV)、感染单位滴度、基因组滴度、病毒空壳率检测、宿主细胞基因组残留、宿主细胞蛋白残留、BSA残留、核酸酶残留等进行检测。
5.4 药理毒理评价
利用PCR技术和基因测序平台可以快速对潜在的脱靶位点进行脱靶概率的检测;利用基因测序平台可对sgRNA/Donor基因编辑效率和脱靶效率进行准确判断,可以有效判断sgRNA/Donor基因编辑的潜在风险,结合iPSC和3D-视网膜类器官培养体系,可以准确有效的对sgRNA/Donor基因编辑在患者体内的真实基因编辑的有效性、安全性进行判断。
5.5临床研究
基因替代治疗,国际上超过10项临床试验正在进行;
基因编辑治疗,Editas公司2018年夏将开展首次临床实验(CEP290基因所致IRDs)。
编辑|药圈ruby


{replyUser1} 回复 {replyUser2}:{content}