2019年医药行业年度回顾:医药政策
行业研究栏目,将从二级市场、一级市场、医药政策三个方面进行2019年度总结回顾。本期为医药政策年度总结,将从临床试验设计与程序优化、注册人知度、医疗器械唯一标识(UDI)、药品与器械集中采购等方面进行政策解读。
2017年中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,是药品与医疗器械审批改革的重要里程碑,相关规章对于后续法规都有深刻的影响,并落实到企业、医保和医院等各领域,见图一。
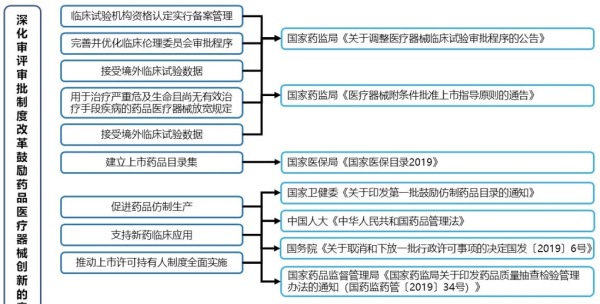 图一:2019年政策与《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》关联图
图一:2019年政策与《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》关联图
临床试验设计与审批程序优化
2018年1月国家药监局《医疗器械临床试验设计指导原则》对于临床试验的设计提出具体的可操作性要求,增加对临床试验的可行性,为后续审批相关政策提供基础。2019年3月,国家药监局《关于调整医疗器械临床试验审批程序的公告》进一步优化医疗器械临床试验审批程序,由“明示许可”转变为“默认许可”,受理临床试验申请后一定期限内,食品药品监管部门未给出否定或质疑意见即视为同意,申请人可按照提交的方案开展临床试验,在用于罕见病或治疗严重危及生命且尚无有效治疗手段疾病的药品与医疗器械放宽规定,并于2019年12月国家药监局发表《医疗器械附条件批准上市指导原则的通告》加以规范,此外接受境外临床试验数据,有助于避免重复性临床试验,加快先进医疗器械的国内同步上市。
注册人制度
2019年8月,中华人民共和国第十三届全国人民代表大会常务委员会第十二次会议通过《中华人民共和国药品管理法》,从法律层面支持药品改革,提出上市持有人制度,使得药品生产从重资产变成重监管,持有人需对药品全周期承担责任,建立全面药品监管回溯制度,取消GMP/GSP认证。审批层面临床实验审批改为默认许可,推动加速新药审批并加速上市。建立医保的动态目录,医保目录以每年至少一次调整为目标。
推动器械上市许可持有人制度全面实施,允许医疗器械研发机构和科研人员申请医疗器械上市许可,主要参考国际通行的MAH(Marking Authorisation Holder)制度与药品上市许可持有人制度,2017年12月上海药监局颁布《中国(上海)自由贸易试验区医疗器械注册人制度试点工作实施方案》,由上海市首先试点并于2018年底7个产品获批上市。一方面将“注册”与“生产”进行松绑,有利于科研人员持有研发成果,另一方面,落实上市许可器械或药品持有人法律责任,对于临床研究和生产制造等承担全部法律责任,确保提交的研究资料和临床试验数据真实、完整、可追溯,监管部门以往重审批模式将转变为重监管模式,对于企业的全周期进行监管。
注册申请人可以选择自行生产、合作生产或委托生产等方式,对于现有企业相关的许可证转移的合规性与效率性等,都对于企业效率优化具有重要影响,而创新企业的注册申请人则可以减少研发转换中投入大量的资本和管理,寻求合作将企业转型为主的轻资产运营。
医疗器械唯一标识(UDI)
建立医疗器械唯一标识系统,有助于延续并落实注册人制度,完善医疗药品与器械再评价体系,加强医疗器械全生命周期管理,有效减少重复申报等。2019年7月国家药监局颁发《关于印发医疗器械唯一标识系统试点工作方案(药监综械注〔2019〕56号)》,确立相关工作办法与部门职责,以心脏、颅脑植入物、假体类等高风险植(介)入类医疗器械为重点品种,同时覆盖不同种类的典型产品,预计2020年7月,总结试点报告,完善首批产品唯一标识实施方案。2019年8月,国家药监局《医疗器械唯一标识系统规则的公告(2019年 第66号)》,确立医疗器械唯一标识系统规则和相关细则,于同年10月1日正式实施。
药品追溯码
2019年4月,国家药监局《药品信息化追溯体系建设导则》和《药品追溯码编码要求》发布追溯体系建设指南、统一药品追溯编码要求、数据及交换标准。通过药品信息化追溯体系是药品上市许可持有人、生产企业、流通和使用等各环节的信息进行追踪,药品上市许可持有人和生产企业应履行药品信息化追溯管理责任,切实履行主体责任,为社会公众提供信息查询,药品验收反馈上游企业,销售药品保存销售记录明细,并及时调整售出药品的相应状态标识。信息化追溯体系实施后,用药安全得到保障,销售回流药物将成为历史,使得正规企业得到保障。
药品与器械集中采购
上海阳光医药采购网在官网发布《联盟地区药品集中采购文件》,以国家组织药品集中采购和使用试点城市(4+7城市)及已跟进落实省份执行集中采购结果的基础上,组织相关地区形成联盟,依法合规开展跨区域联盟药品集中带量采购。
2019年7月,国务院办公厅印发《治理高值医用耗材改革方案的通知(国办发〔2019〕37号)》,指出制定医疗器械唯一标识系统规则,并统一编码体系和信息平台,实施高值医用耗材价格信息共享和联动机制,取消公立医疗机构医用耗材加成,通过市场产量与销量实行医保准入和目录动态调整,实行高值医用耗材目录管理,逐步实施高值医用耗材医保准入价格谈判,实现“以量换价”,形成稳定价格并明确医保支付标准,未来高值医疗耗材的高毛利率时代将受到严重影响。
疫苗相关法规
2019年3月国务院办公厅《疫苗管理部际联席会议制度的函(国办函〔2019〕27号)》和2019年6月第十三届全国人民代表大会常务委员会第十一次会议通过《中华人民共和国疫苗管理法》,对于疫苗相关法律的顶层设计,明确疫苗制造的规范与疾病控制机构等法律规章。
疾病诊断相关分组(DRG)
2019年6月,国家医保局、财政部、国家卫健委、国家中医药局《关于印发按疾病诊断相关分组付费国家试点城市名单的通知(医保发﹝2019﹞34号)》确定了北京、天津、河北省邯郸市等30个城市作为DRG付费国家试点城市,制定医保支付的DRG分组和医保信息采集,对不能采用DRG结算的病例,进一步推进依据大数据的按病种付费。
2019年10月国家医疗保障局《国家医疗保障DRG分组与付费技术规范》和《国家医疗保障DRG(CHS-DRG)分组方案》指出按照统一的分组操作指南,各试点城市不得随意更改MDC和ADRG组别。
要求医院统一使用医保疾病诊断和手术操作、医疗服务项目、药品、医用耗材、医保结算清单等5项信息业务编码标准,与医疗器械唯一标识和药品追溯码结合对于器械药物的使用进行追踪并联动,未来按照项目付费将转变为按病种付费。
公立医院考核制度
2019年8月,国家卫生健康委发布《按照属地化原则开展三级公立医院绩效考核与数据质量控制工作的通知》与印发《国家三级公立医院绩效考核操作手册(2019版)的通知》,通过绩效考核,推动三级公立医院在发展方式上转向质量效益型,将病案首页、用药模式与满意度评价等列入绩效考核。
医疗改革未来方向
2019年11月国务院深化医药卫生体制改革领导小组《关于进一步推广福建省和三明市深化医药卫生体制改革经验的通知》重点在于切实加强医疗服务监管,严格医疗机构用药管理,规范公立医院集中采购药品目录,及时相应调整医疗服务价格,建立动态调整机制,实行医用耗材阳光采购,并及时相应调整医疗服务价格,实现结算中心的医保基金对医药企业的直接支付和结算。
医院层面优化医院收入结构,院长年薪由财政承担,根据绩效考核结果发放,综合考虑医疗服务收入增长、院长年度绩效考核等因素,每年适当增加公立医院薪酬总量。对医院运行、门诊和住院次均费用增长、抗菌药物和辅助用药使用等进行监控,对不合理用药等行为加大通报和公开力度。
改革方向以涉及医疗、医保和医药等多方医疗改革,包括改革医疗机构薪酬分配与激励机制、强化中央对医疗机构的监督管理、完善医保支付体系与按病种收费模式、促进医疗资源合理分配等。


{replyUser1} 回复 {replyUser2}:{content}