盘点2021年1-5月首次获CDE承办的国内1类NDA申请
文 | 药疯
5年前,国内药企如果能拿到一个1类新药的IND,称之为里程碑事件都不为过,而今,IND几乎“贬值”到了只是公司每年众多KPI中的一项而已,这就是我国创新药发展的速度!相比而言,NDA就显得更加具有说服力,毕竟敢于面对市场,更可以证明药企对自家产品的高度自信。那么,2021年当前国内的1类新药NDA申请都有哪些品种值得期待呢?
1. 2021年1-5月首次获CDE承办的国内1类NDA申请
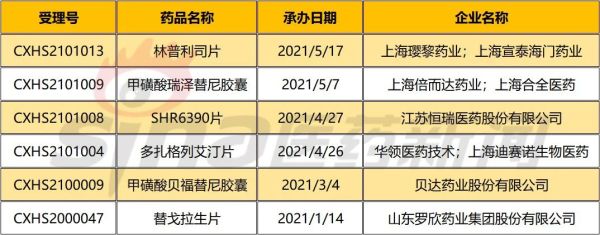
通过官网数据了解到,2021年1-5月首次获得CDE承办的国内1类NDA申请,主要有6项。按时间顺序,分别为山东罗欣药业的替戈拉生片、贝达药业的甲磺酸贝福替尼胶囊、华领医药的多扎格列艾汀片、江苏恒瑞的SHR6390片、上海倍而达药业的甲磺酸瑞泽替尼胶囊、上海璎黎药业的林普利司片。
表1.1 2021年1-5月首次获CDE承办的国内1类NDA申请
2. 6个NDA品种主要概况
新药品种进入到NDA阶段,就大不同于早期的IND阶段,此时通常会有大量的信息披露出来,比如专利信息、结构信息、临床前信息、临床信息、开发合作信息等等。现将6个NDA品种的主要信息介绍如下——
01 替戈拉生片
替戈拉生,又为LXI-15028,为钾离子竞争性酸阻滞剂类药物(P-CAB),申办方为山东罗欣。与质子泵抑制剂不同,P-CAB可直接抑制H+/K+-ATP酶,而无需在强酸环境下活化,且无论H+/K+-ATP酶活化与否,P-CAB均可与之结合。
2015年10月,山东罗欣与韩国CJ Health Care Corporation达成协议,获得替戈拉生中国境内开发、生产及商业化权益;2016年12月,山东罗欣按照化药1类的注册分类递交了新药临床试验申请,于2017年6月获得临床试验批件;现,替戈拉生片上市申请获得受理。
一项多中心、随机、双盲、平行对比艾司奥美拉唑治疗中国糜烂性食管炎患者8周的III期临床研究:共纳入261名成人糜烂性食管炎中国患者,按1:1的比例被随机分配至试验组(LXI-15028一天一次,每次50mg)和对照组(艾司奥美拉唑一天一次,每次40mg),结果证明LXI-15028治疗8周的累计内镜愈合率非劣于艾司奥美拉唑。
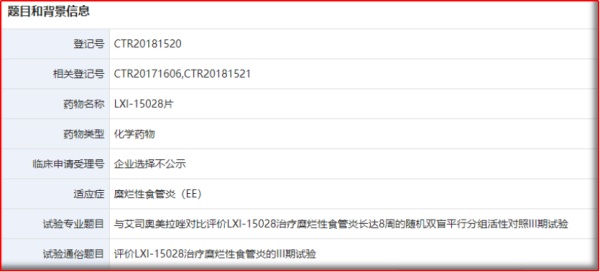
图2.1 LXI-15028登记的III期临床研究
02 甲磺酸贝福替尼胶囊
甲磺酸贝福替尼胶囊,申办方为贝达药业,属三代EGFR-TKI。一项多中心、开放、单臂II期临床研究,评估研究了药物在既往接受一代或二代EGFR-TKI治疗后产生耐药且EGFR-T790M突变阳性的局部晚期或转移性NSCLC患者中的疗效和安全性。
该研究由上海市胸科医院牵头开展,全国共计超过50家研究中心参与,共纳入了176例受试者至50mg剂量组,290例受试者至75-100mg剂量组。75-100mg剂量组受试者先经甲磺酸贝福替尼75mg QD治疗21天作为导入期,若耐受性良好,则升高剂量至100mg QD。
截至2020年10月,数据显示甲磺酸贝福替尼胶囊75-100mg治疗既往使用EGFR-TKI耐药后产生T790M突变的局部晚期或转移性非小细胞肺癌患者,188例患者经独立评审委员会评估确认为PR,客观缓解率为64.8%,疾病控制率为95.2%。34例基线有脑转移的患者中,18例经IRC评估确认为PR,颅内客观缓解率为52.9%,颅内疾病控制率为97.1%。最常见的不良反应为血小板减少症、头痛、白细胞计数降低、贫血、皮疹;最常见的严重程度≥3级不良反应为血小板减少症。
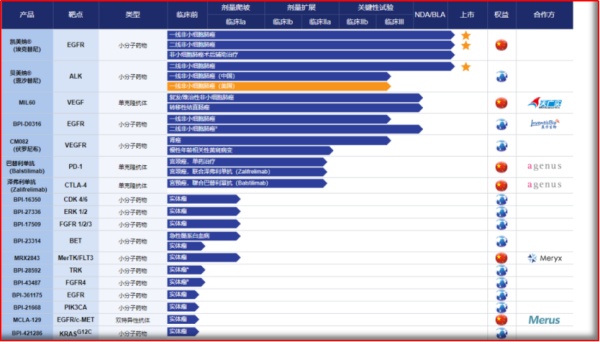
图2.2 贝达药业新药研发管线
03 多扎格列艾汀
多扎格列艾汀,又为Dorzagliatin(HMS5552),申办方为华领医药,是全新作用机制的葡萄糖激酶激活剂(GKA),旨在通过对2型糖尿病患者血糖传感器葡萄糖激酶(GK)的功能修复,重塑人体血糖稳态,达到治疗2型糖尿病的目的。
临床前及已完成的III期临床研究表明:II期和III期研究中降糖效果明确,几无低血糖,显著改善β细胞功能,具有改善T2DM损伤的GK功能和改善血糖稳态的潜力。最新研究表明,多扎格列艾汀可以显著提高胰岛α细胞GLP-1的表达,从另一个角度起到保护胰岛β细胞的作用。多扎格列艾汀有望成为全新机制治疗2型糖尿病的新一代药物,既可以作为单药使用治疗初发和早期2型糖尿病患者,也可以采用糖尿病个性化治疗的方案,与当前临床使用的抗糖尿病药物联合使用。
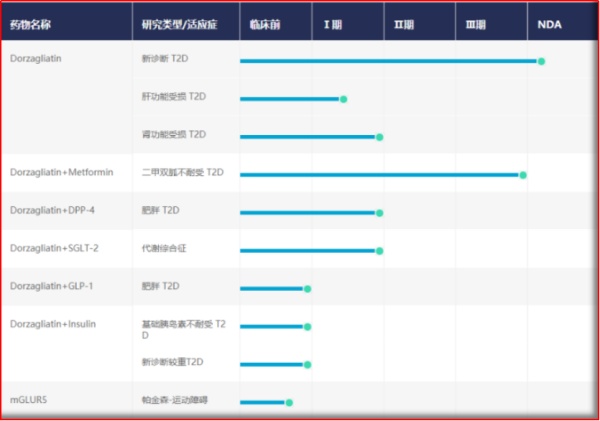
图2.3 华领医药新药研发管线
04 SHR6390片
SHR6390,申办方为恒瑞医药,是一种口服、高效、具选择性的小分子CDK4/6抑制剂,其开展的多项临床研究主要相关乳腺癌在疾病发展不同阶段的治疗用药;该品种已纳入优先审评。另,FDA批准上市的CDK4/6抑制剂共4个,分别为帕博西尼、瑞博西尼、阿贝西尼、曲拉西尼。
根据报道,SHR6390对激酶CDK4和CDK6的抑制作用比较显著,IC50近于10nM;对激酶CDKl和CDK2的IC50均>10000 nM,对CDK9的IC50>4000 nM。除了Calu-3细胞外,SHR6390显著的抑制了大多数RB阳性肿瘤细胞系的增值,而对RB阴性的MDA-MB-468细胞基本无效,且对RB低表达的细胞作用有限,如SNU-182和OVCAR-3细胞。所以,这些结果显示SHR6390对RB阳性的肿瘤细胞有广谱抗肿瘤活性,且未表现出明显的组织特异性。
而根据ASCO大会披露:2016年4月~2018年12月,入组晚期乳腺癌患者40例。剂量爬坡阶段未获得MTD;剂量拓展阶段,在100mg、125mg和150mg三个剂量组各拓展至10例患者;22例(55%)患者发生≥3级不良事件,包括中性粒细胞降低、白细胞减少、血小板减少和高血压;未观察到严重不良事件。单次给药50-175 mg,药物浓度在2.5-4小时达到峰值,随后在体内缓慢消除,血浆药物消除半衰期为40.3-51.4小时。在连续给药第8天血药浓度达到稳态,稳态时的Cmax和AUC0-∞随给药剂量增加而增加。
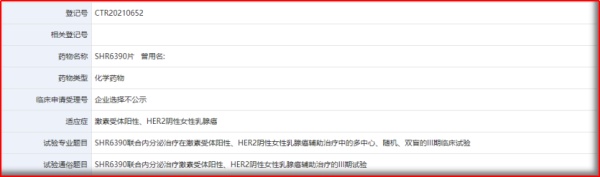
图2.4 SHR6390近期登记的临床研究
05 甲磺酸瑞泽替尼胶囊
甲磺酸瑞泽替尼,又为BPI-7711,申办方为上海倍而达药业,为第三代EGFR-TKI,该方向的全球重磅炸弹品种为奥希替尼。
2019年10月,在国际肺癌研究协会举办的2019北美肺癌大会上,BPI-7711用于治疗EGFR/T790突变非小细胞肺癌患者的一期临床结果公布。该项研究目的是确定BPI-7711在1代/2代EGFR-TKI治疗后进展晚期或复发性EGFR/T790M突变的NSCLC患者中的安全性和有效性,在128例可评估疗效的病人中:客观缓解率(ORR)为63.3%;疾病控制率(DCR)为93.8%;在二期推荐剂量180mg组中(n=52)ORR为73.1%,DCR为96.2%;在51例脑转移患者中,ORR为35.3%,DCR为96.1%;在二期推荐剂量180mg组中(n=52)ORR为44%,DCR为100%,且显示出优异的治疗效果。

图2.5 上海倍而达新药研发管线
06 林普利司片
林普利司,又为Linperlisib(YY-20394),申办方为上海璎黎药业有限公司,为抗肿瘤品种,2020年获得国内的突破性治疗药物认定,用于治疗复发和/或难治滤泡性淋巴瘤,是上海首家获得“突破性疗法”药物认定的品种,按照法规该品种申请上市许可的审批时间将由原来的200日缩短至130日。另,该品种还获得了FDA颁发的针对滤泡淋巴瘤和慢性淋巴细胞白血病适应症的两项孤儿药资格认定。作为璎黎药业研发的新一代PI3Kδ(磷酯酰肌醇3-激酶亚型δ)高选择性抑制剂,林普利司已有的临床数据显示出了其良好的安全性和显著疗效;对复发难治的滤泡性淋巴瘤患者的有效率高达90%,且患者每天只需口服1次,在安全性、有效性和用药依从性上均优于同类已上市药品。
2021年3月29日,璎黎药业宣布其自主研发新药Linperlisib用于治疗复发/难治滤泡性淋巴瘤II期注册临床试验初步完成,试验结果表明,针对意向治疗人群,Linperlisib在有效性和安全性方面均取得了统计和临床意义的提高。如独立数据评估(根据淋巴瘤疗效评价标准IRWG评估)结果显示:Linperlisib在89例(可评估病例)复发/难治滤泡性淋巴瘤的患者中,客观缓解率达80%以上,疾病控制率达95%以上。同时,从统计结果分析来看,Linperlisib口服给药安全可控、耐受性好。恶心等常见的胃肠道不良反应和同类药物特别关注不良反应如腹泻、肝毒性等发生率低于同靶点药物文献报道。与传统疗法相比,Linperlisib并未发现呕吐、脱发、静脉炎、心脏毒性等副反应,且极少导致全血细胞重度减少,服药过程一般不需要住院监测,携带方便,大大的提升了患者的生活质量。
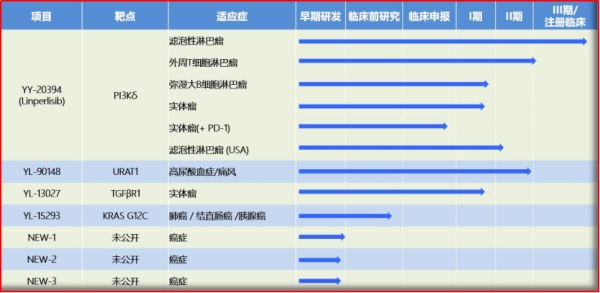
图2.6 璎黎药业新药研发管线
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}