FDA半年批29款新药上市!辉瑞缺席 新秀BridgeBio开始收割
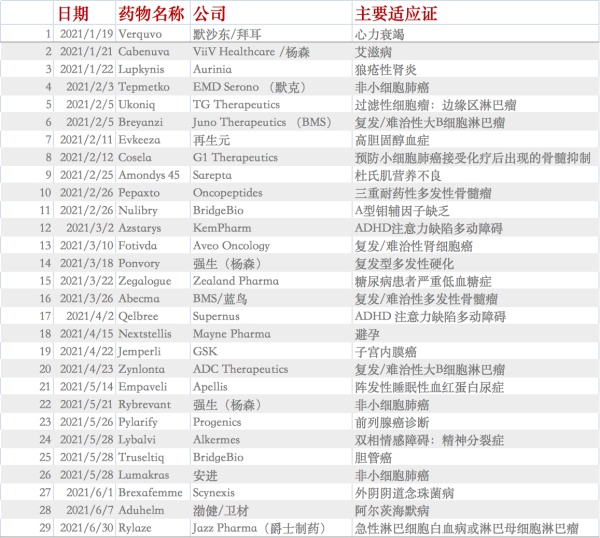
疫情之下,处于舆论漩涡之中的FDA并没有放缓新药上市的步伐。统计显示,截至6月30日,FDA已经批准了29款新药上市。最猛的是2月份,FDA批准了8款新药上市。
数据显示,2018年FDA创历史的批准了59款新药,2019年批准了48款新药,2020年的数据是53个。
在上半年获批的29款药物中,肿瘤药仍是主流,占据批准药物的44%,这一比例也已超出2020全年。2020年,获批上市的53款药物中有20种为肿瘤药物。
获批的新药中,阿尔茨海默病药物Aduhelm的上市,引发了无数讨论,甚至被业内人士称为是“一场灾难”,“可能是美国近期历史上最糟糕的药物批准决定”。
但是在 Aduhelm之外,今年还有许多备受瞩目的新药上市。
例如被称为艾滋病治疗的革命性药物Cabenuva,该药物的研发可谓是巨头协作的典范,其药物上市不仅惠及了患者,还直接或者间接的令四家制药巨头获益。还有治疗狼疮性肾炎的第一个口服药物LUPKYNI,该药物来自加拿大奥里尼亚制药公司Aurinia;还有首个新一类抗真菌药Brexafemme,用于治疗外阴阴道念珠菌病等新药。
对于企业而言,比较遗憾的是辉瑞缺席。而强生(杨森)可谓是今年上半年的大赢家。不仅通过大型三期头对头试验,让Ponvory获批用于治疗复发型多发性硬化症(MS)成人患者。其Rybrevant还凭借一期临床数据加速上市,成为FDA批准的第三款双抗药物。还有杨森与ViiV Healthcare 联合推出的艾滋病药物Cabenuva。
BMS上半年新药的表现也是可圈可点,一口气上市了两款CAR-T药物。其中之一得益于收购新基得来的Breyanzi,主要用于治疗经过两次或两次以上系统治疗的复发或难治性大B细胞淋巴瘤成年患者。另一款则是与蓝鸟合作开发的Abecma,抢夺了FDA批准的首个靶向BCMA的CAR-T细胞治疗之位。
而在新药上市数量上可以与强生、BMS匹敌的则是国内相对陌生的BridgeBio。BridgeBio收获了两款新药,分别是Truseltiq 和Nulibry。该公司的主要研发领域是由于单基因缺陷而导致的罕见病,以及具有清晰遗传驱动因子的癌症。
2019年6月BridgeBio通过IPO融资了3.48亿美元,夺得该年度生物科技最大IPO桂冠。在今年上半年高瓴也对其进行了增持。BridgeBio最为人称道的是其运营模式,BridgeBio倾向的是建立多个子公司,每个子公司享有半自治运营权,共享母公司资源,负责母公司特定的业务。
此外,跨国MNC中,默沙东、拜耳、默克、再生元、GSK上半年也都有所收获。值得关注的是正在加速转型的GSK,收获了全球第7款PD-1药物Jemperli ,是首个治疗子宫内膜癌的抗PD-1疗法,而该药物是通过收购Tesaro而来。尽管是第7款PD-1,其价格仍高于其他同类药物,有业内人士预估其每月收费约为1.5万美元。
而中国企业对于FDA批准的新药,早有所行动。
例如Scynexis研发的Brexafemme (ibrexafungerp),该药物是女性健康领域抗真菌感染的重大突破,也是20多年来首个获批的全新作用机制的第四代抗真菌类药物。而豪森在今年2月17日,即与Scynexis签订战略合作协议,获得Brexafemme在大中华区(包括香港、澳门及台湾)开发和商业化的独家权益。
而上半年获批的Truseltiq,联拓生物早在2020年8月,就已经与BridgeBio合作,获得了Truseltiq的肿瘤学授权许可,并负责该药物在大中华区(中国大陆、香港、澳门)的临床开发、注册申请和未来的商业运营。根据对外披露信息显示,联拓生物将获得BridgeBio超过20种管线产品在中国及其他亚洲主要市场的优先使用权。
01 巨头协作典范:Cabenuva
这不仅是一个复杂的药物,其背后也有一个复杂的公司。
Cabenuva 的批准上市,被业内称为是艾滋病治疗的革命。这是用于成人治疗HIV-1感染的第一个也是唯一一个完整长效方案。Cabenuva的上市将全年每天365天口服转变为每月注射一次全年仅需注射治疗12天。
Cabenuva由ViiV与强生旗下杨森制药合作开发,该药物由ViiV公司的cabotegravir(CAB,卡博特韦)和强生的rilpivirine(RPV,利匹韦林)组成。
而ViiV Healthcare则由GSK、辉瑞和盐野义持股的艾滋病药物研发公司。这也意味着 Cabenuva这颇具革命性的药物背后,受益的不仅仅是患者,还有这些药企。
02 强生(杨森):上演勇敢者的游戏
例如Ponvory是FDA批准的第一个也是唯一一个针对已上市口服疗法进行对照研究的口服疾病修正疗法。
Ponvory 是一种每日一次、口服、选择性鞘氨醇-1-磷酸受体1(S1P1)调节剂,用于治疗复发型多发性硬化症(MS)成人患者,包括临床孤立综合征(CIS)、复发-缓解型多发性硬化症(RRMS)、活动性继发进展型多发性硬化症(SPMS)。
此次批准,主要是基于Ponvory与Aubagio的大型头对头三期OPTIMUM研究(NCT02425644)的结果,该研究在RMS成人患者中开展,比较了ponesimod与Aubagio的疗效、安全性和耐受性。
结果显示,与目前市面上的口服MS药物Aubagio(相比,Ponvory在降低年复发率方面显示出优越疗效(年复发率减少近三分之一),而且已有超过10年的累积临床研究数据证明了其有效性和安全性。
而其收获的另一款新药Rybrevant,则从一定程度上表明了FDA的“勇敢”。5月21日,FDA加速批准强生公司EGFR/c-Met双抗Rybrevant(Amivantamab)上市,主要用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。
这是FDA批准的首个针对该类突变的药物。也是获批上市的第四款,FDA批准的第三款双抗药物。在此之前的三款双抗产品分别为 Removab、Blincyto 和 Hemlibra。
值得关注的是强生的此款药物是凭借1期试验结果获得FDA加速审批上市。
该药物在2020年3月获得了FDA突破性疗法认证(2020年10月获得了中国突破性疗法认证)。该项批准基于 CHRYSALIS 研究的数据。CHRYSALIS 是一项多中心、非随机、开放标签、多队列的临床试验(NCT02609776),纳入了 81 名在铂类化疗中或治疗后疾病进展的 EGFR 外显子 20 插入突变的局部晚期或转移性 NSCLC 的患者。患者每周接受一次 amivantamab-vmjw,持续 4 周,然后每 2 周接受一次,直到疾病进展或出现不可接受的毒性。
其主要疗效终点指标结果显示,ORR达到40%(95%CI:29%,51%),中位缓解时间为 11.1 个月(95%CI:6.9,NE)。
03 BMS:收获两款CAR-T新药
今年上半年,BMS在CAR-T领域一下子收获了两款新药。
这两款药分别是3月份获批的Abecma,该药物由BMS与蓝鸟联合开发,主要用于治疗复发或难治性多发性骨髓瘤成人患者,这些患者既往接受过包括免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体在内的四线及以上治疗。而Abecma是美国FDA批准的首个靶向BCMA的CAR-T细胞治疗。
另一款则是收购新基得来的甜头,Breyanzi。
Breyanzi最早由Juno Therapeutics开发,新基于2018年以90亿美元的价格收购Juno,将Breyanzi收入囊中,而新基在2019年被BMS以740亿美元的价格收购,该产品再次易主。
今年2月,FDA批准Breyanzi用于治疗经过两次或两次以上系统治疗的复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL)(包括惰性淋巴瘤引起的DLBCL)、高级别B-细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级滤泡性淋巴瘤。除了复发或难治性大B细胞淋巴瘤,该药在日本还被批准用于治疗复发或难治性滤泡性淋巴瘤(R/R FL)。
但是Breyanzi的上市还为BMS引来了新麻烦。6月,有外媒消息称前新基股东将BMS告上法庭,指控BMS被指控进行了“公然不当行为”,推迟了CAR-T药物Breyanzi的获批,以避免支付与该药物批准相关的64亿美元里程碑付款。
04 BridgeBio:模式制胜?
值得关注的是这家今年一季度被高瓴加仓的BridgeBio,收获了两款新药。该公司2019年才上市,主要专注于研发遗传疾病药物。
一款是,Truseltiq在今年5月获得FDA加速批准。该药物是一种口服、ATP竞争性、选择性FGFR酪氨酸激酶抑制剂。用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。
另一款药物Nulibry则是一种罕见病用药,主要用于降低因A型钼辅因子缺乏导致的死亡风险。该药物是FDA批准的首款治疗该疾病创新疗法。有数据显示全球共有不到150例患者。
从药物研发模式上看,BridgeBio通过利用一个中央研发平台,同时运营多个药物研发项目。使用这个模型让BridgeBio能够根据项目的进展和需求,分配人员和资金,加速公司运转效率。
来源:E药经理人
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}