美登素——从不可成药到ADC的合金弹头!
文 | 药疯
近年来,ADC用于肿瘤的靶向治疗,受到了制药界极大的关注;其中以美登素衍生物作为细胞毒性成分的ADC药物,更是备受研究者的青睐,且已经取得了一系列的突破性进展。那么,美登素从数十年研究过程中的不可成药,到现今ADC三大核心中的合金弹头,是如何逐渐发展起来的呢?请看本稿件。
一、ADC的三大组件及作用机制
100多年前,即有研究者提出抗体靶向治疗癌症的“魔术子弹”的概念,而随着抗体技术的不断成熟,近年来全球已掀起了ADC的研发热潮。ADC是由“抗体”、“连接子”和“弹头分子”三个主要组件构成,能够特异性识别肿瘤抗原,并形成ADC-抗原复合物通过受体介导的胞吞作用进入靶细胞内部,进一步释放出高活性的弹头分子,从而完成对肿瘤细胞的选择性杀伤。
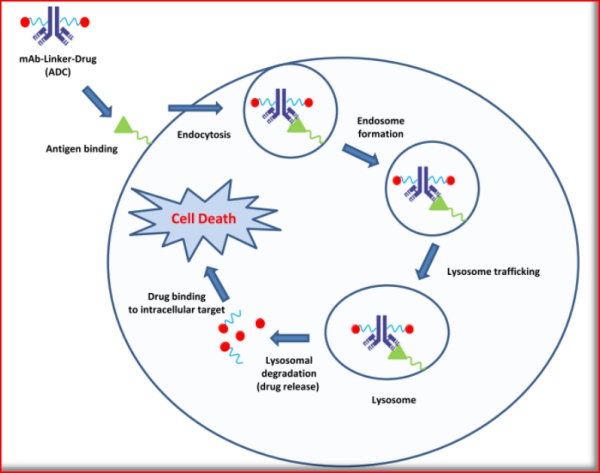
图1.1 ADC作用机制示意图
(Bioorg. Med. Chem. Lett. 24 (2014) 5357-5363)
二、弹头分子如何选择?
在设计第一代抗体药物偶联物时,研究者曾尝试将传统的化疗药物偶联在抗体;但发现,这类ADC无法达到预期的抗肿瘤活性,甚至低于化疗药物本身的疗效;进一步分析发现,主要原因在于ADC经注射后富集于靶部位的剂量低,且化疗药物本身的活性不够强,从而疗效大大减弱;基于此,开始在植物、海洋生物和微生物等天然来源的化合物中寻找新型高效细胞毒性化合物,发现某些化合物在体外对多种肿瘤细胞的抑制活性比传统化疗药物高100~1000倍,IC50值可以达到pM水平;且这些细胞毒素由于治疗安全窗范围较窄,不能作为药物单独使用,故可以考虑用来做ADC的弹头分子发挥作用。
综上,ADC弹头分子通常具备以下特点:1)作用机制明确;2)细胞毒作用极高(通常是pM级别);3)可被修饰,可与linker链接;4)具备一定的水溶性。

图2.1 ADC三大组件的合理设计
(Acta Pharmaceutica Sinica B 2020;10(9):1589e1600)
三、为何选择了美登素?
美登素,为天然生物碱,1972年从卵叶美登木中首先分离得到存在于卫茅科美登木属及其亲缘植物中。美登素机制明确,作用于微管及微管蛋白,通过抑制细胞微管的解聚来阻断细胞有丝分裂过程中纺锤体的形成,具有极强的抑制肿瘤细胞增殖的能力。
美登素是第一个具有抗肿瘤活性的安莎大环内酯类抗生素,它对于鼻咽癌肿瘤细胞KB细胞(EC50=8pM)、鼠类淋巴细胞性白血病P-388细胞(EC50=0.6pM)和鼠白血病L1210细胞(EC50=2pM)均具有很强的杀伤活性,且同时具有良好的稳定性和溶解性。
由于美登素治疗窗窄以及缺乏选择性带来的毒副作用,如神经毒性和胃肠道反应等,使其单用时并不能成为一种真正的肿瘤化疗药物,临床上已被禁止直接用于人体治疗。不过,美登素的高细胞毒性恰好可满足ADC对毒素的要求,这使得美登素及其衍生物在ADC的研发中得到了广泛应用并获得成功。
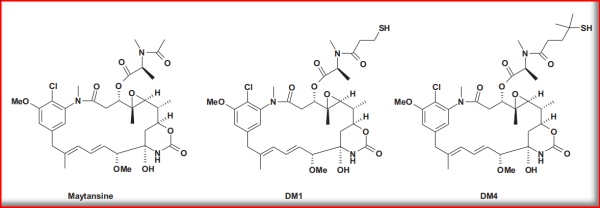
图3.1 美登素及其衍生物结构
(Bioorg. Med. Chem. Lett. 24 (2014) 5357-5363)
四、修饰后,正式登上临床舞台
如上,美登素及其衍生物的结构可知,美登素衍生物主要含有巯基,并通过linker同单克隆抗体进行连接,形成抗体药物偶联物;DM-1和DM-4是目前临床实际应用中最常用的2个美登素类ADC效应分子,可通过发酵得来的安丝菌素还原成美登醇,C3位再与连有二硫键的酸缩合,最终还原成末端巯基得到。
以美登素类作为弹头分子的ADC一般采用与抗体赖氨酸残基偶联的方式,DM1型ADC通常使用不可裂解型双功能连接子SMCC,在细胞内经溶酶体降解为Lys-SMCC-DM1形式。DM4型ADC一般使用可裂解型连接子为SPDB或SPP,在细胞内首先分解为Lys-SPDB/SPP-DM4,再经内源性谷胱甘肽还原,二硫键断裂成SH-DM4,直接发挥作用或部分甲基化发挥更强的抗肿瘤作用。
另,美登素衍生物的抗肿瘤活性评价数据表明,DM1、DM4相比于美登素细胞活性有所下降,可能是由于巯基在体内易被氧化成带有电荷的基团而难以进入细胞。另一方面,DM1和DM4在代谢过程中巯基发生甲基化产生的衍生物和通过自身分子间缩合形成的二聚体,均具有与美登素相当或更高的活性。

图4.1 美登素类细胞毒药物
(Bioorg. Med. Chem. Lett. 24 (2014) 5357-5363)
五、美登素已上市药物Kadcyla及其他在研品种
Kadcyla(Trastuzumab Emtansine,T-DM1),即曲妥珠单抗-SMCC-DM1,由罗氏旗下的基因泰克开发;2013年美国FDA通过优先审查程序批准Kadcyla用于治疗HER-2阳性的晚期(转移性)乳腺癌患者;这是第一个被批准上市的基于美登素衍生物的ADC药物。
随后,2014年4月,Trastuzumab Emtansine在日本获批上市,用于治疗HER2阳性的不可手术或复发性乳腺癌患者;2019年5月,FDA批准Trastuzumab Emtansine用于HER2阳性早期乳腺癌的辅助治疗;2019年12月,EMA批准该药物用于辅助治疗HER2阳性早期乳腺癌,接受基于紫杉烷类和HER2靶向治疗的新辅助治疗后乳腺和/或淋巴结有残留浸润性疾病的患者;2020年8月,日本批准用于辅助治疗HER2阳性早期乳腺癌的申请。
全球销售额方面,该产品自2013年上市,于2018年突破10亿美元,2020年突破18亿美元,预计未来5年的销售额将在22~30亿美元之间。
基于上述美登素为弹头的Trastuzumab Emtansine的临床表现和市场表现,现已有多款美登素ADC药物进入到临床II/III期,且弹头仍集中于DM1/DM4;而靶点进一步扩展到FOLR1、CD37、CD56、CD19、CD138、Mesothelin、CA6,等;适应症也进一步扩展到卵巢癌、子宫内膜癌、肺癌、弥漫性B细胞淋巴瘤、滤泡性淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤、白血病、胰腺癌,等等。
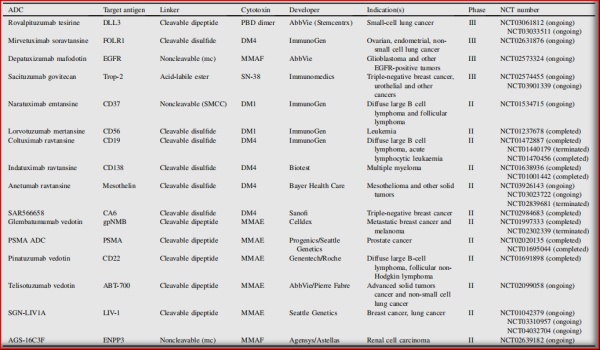
图5.1 部分处于III期和II期开发的ADC
(Acta Pharmaceutica Sinica B 2020;10(9):1589e1600)
六、小结
以上,即为美登素从活性过强、安全窗窄、毒性明显的不可成药,到如今以ADC合金弹头的身份成功被应用到临床治疗的简要研发过程。实际上,除美登素外,还有很多强细胞毒物质被用于临床开发,如海兔毒素、奥瑞他汀类、卡奇霉素类、倍癌霉素类、喜树碱类衍生物等等,这些相关的研究都非常值得关注。且随着近年来越来越多的不可成药变为可能,许多研究多年甚至被暂停的领域都有变为蓝海市场的可能,那么,无论是对于业内人士还是对于行业投资者,技术的突破与快速发展,就需要格外的关注与深入研究。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}