2022年上半年新药获批盘点:26款新药以抗肿瘤为主,在美首批药物最多,中国自研新药速度加快
2022年已经过去一半,COVID-19疫情还在继续,疫苗和治疗药物的批准范围在扩大,也正是有药物预防和控制,新药临床开发和获批速度没有被减慢,中美欧药品管理部门批准的新药中仍以抗肿瘤药物为主,其次是抗感染药物。FDA授予的突破性治疗数量认定(BTD)数量相对于去年有所减少,发布了关于“撤销BTD的考虑“指南草案,无论对于监管方或申办方,之后BTD药物资格的维持或撤销都会更有挑战性。
01
PART
中美欧批准新药以抗肿瘤为主
中美欧三个国家地区在2022年上半年药品监督管理部门批准上市的新药,按适应症分,仍以抗肿瘤药物为主,其中中国批准的肿瘤药最多。除了国外制药公司在中国获批新药外,中国自研国产创新药获批速度也在加快,包括复宏汉霖的斯鲁利单抗、康方生物的卡度尼利单抗和恒瑞医药的瑞维鲁胺片等。
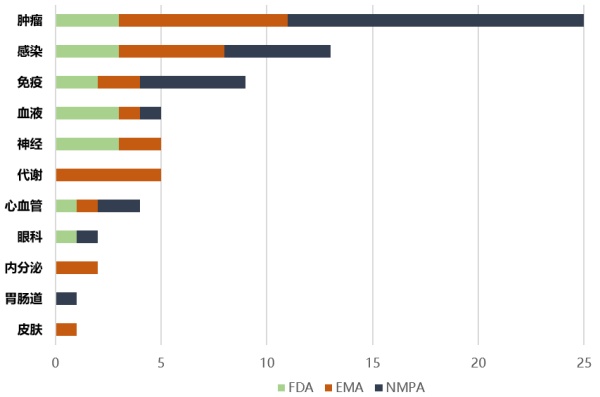 2022年上半年中美欧批准上市新药疾病分布
2022年上半年中美欧批准上市新药疾病分布
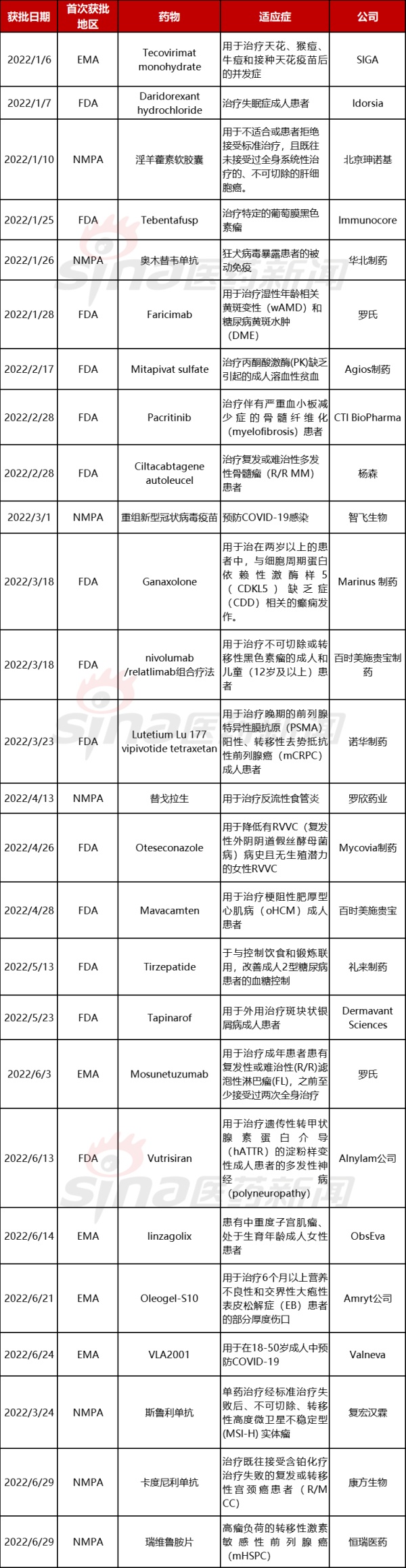
全球首次批准的药物中,FDA依然是最多的,达14个,EMA有5个,中国自研新药的速度也在加快,有7个。虽然小分子药物依然是主要的药物类型,在生物药物方面形式主要为抗体药物和基因修饰细胞疗法。
全球首次批准的新药
02
PART
新冠药物持续销售增长
2022年COVID 19病毒所造成的疫情仍然在持续,获批的新药中分类排名第二的抗感染药物,EMA和NMPA都有批准用于COVID-19治疗的药物和预防的疫苗。
BioNTech/辉瑞公司的疫苗Comirnaty、Moderna的疫苗Spikevax和辉瑞公司的口服治疗轻中度型新冠肺炎药物Paxlovid依然会是针对新冠感染的药物销量前三名。
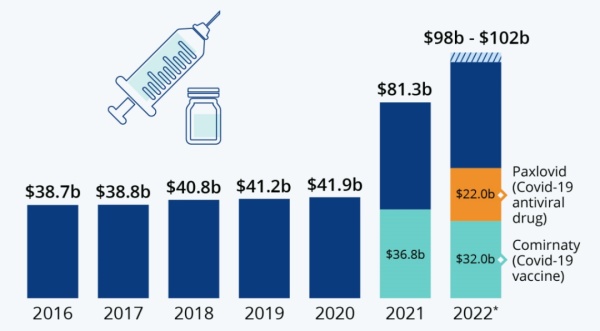 辉瑞药物年销售额(2022年为预测)
辉瑞药物年销售额(2022年为预测)
Comirnaty在2021年销量占全部COVID-19疫苗的60%,根据辉瑞公司预测,2022年Comirnaty的收入将达到320亿美元,在2022年第一季度销售额已经达到132亿美元,销售额的增长主要来自于用于18岁及以上人群加强针(booster dose)的紧急使用授权(EUA)和Comirnaty初始剂量(即两针注射)的EUA批准年龄已经拓展至儿童人群,包括包含6个月至5岁及以上儿童。
随着口服COVID-19治疗药物Paxlovid获得了包括EMA或NMPA等更多国家和地区的EUA,辉瑞预测其2022年销售额将达到220亿美元,2022年第一季度已经能达15亿美元。
随着用于COVID-19病毒获批的疫苗和药物增多,此前收到COVID-19影响的临床试验进度也已经慢慢回到正轨,包括此前因为疫情影响而推迟的启动和入组计划,并且从目前各个药品监管机构批准药品上市的情况来看,已经不受疫情影响。
03
PART
FDA突破性治疗认定有所改变
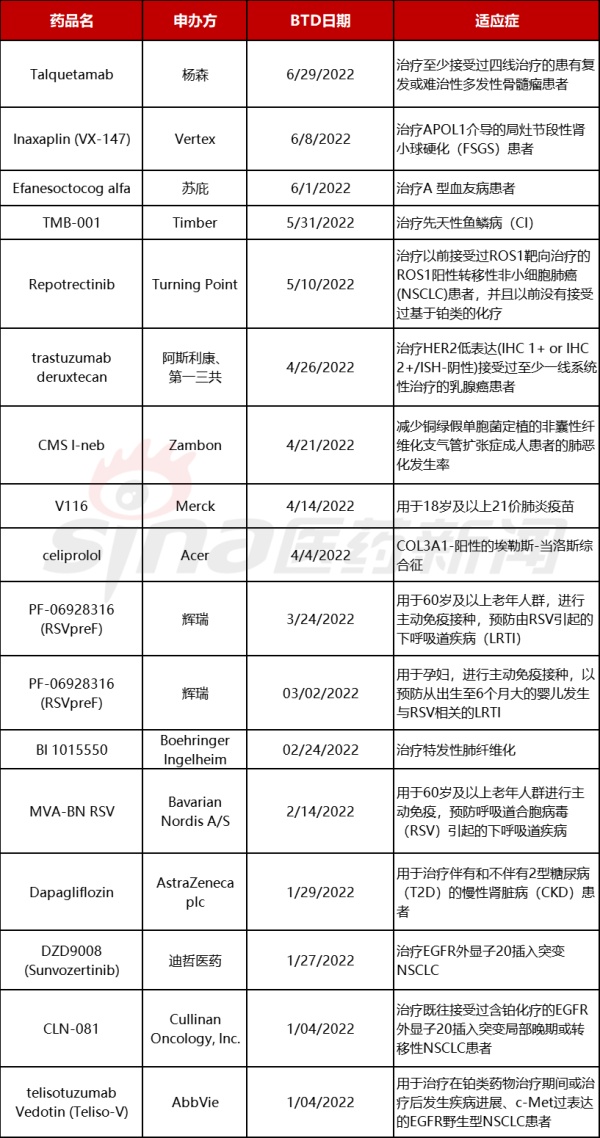
FDA于6月23日发布了名为“撤销突破性治疗认定(BTD)的考虑”的指南草案,解释了何时会考虑撤销BTD。BTD旨在加速开发和审查治疗严重或威胁生命疾病的潜在新药,当药物能用于治疗严重或危及生命的疾病,且初步临床试验表明该药较现有疗法有显著改善,如临床开发早期观察到的明显疗效,可考虑获得BTD资格。2022年上半年FDA的BTD药物数量仅有17个,相对于2021年上半年授予25个有所减少。数量减少可能也是因为对于涉及投入大量开发资源的BTD药物的谨慎态度,谨慎授予和谨慎撤销。
FDA在指南草案中指出会从以下三个方面考虑撤销BTD:一、另一种新药的能够满足未满足临床需求而获批,且该药在BTD药物的认定理由范围内,使得BTD药物不再符合关于对现有疗法进行实质性改进的标准,该认定药品将会被撤销BTD认定资格。二、当BTD药物的新临床数据不再支持“初步临床证据表明该药物可能比现有疗法有显著改善。三、申办者不再针对BTD确定的的计划进行开发。
FDA 进一步解释:“如果一项旨在明确显示指定药物效果的 III期试验未能达到其主要终点,或者受益程度较为适中,以至于该试验并未表明该药物可能证明比现有疗法有显着改善。改变BTD药物获益风险评估的安全信息的出现也可能支持撤销 BTD 的决定。”
2022年上半年获得FDA BTD的药物
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}