一文初识:创新药开发之“遗传毒&生殖毒&致癌”
前言:药品三大属性,安全、有效、质量可控;安全~为最基本的前提条件。对于新药的安全性评价,除了耳熟能详的急毒、长毒外,实际上还有很多相关的毒性研究试验,如本文所述的“遗传毒、生殖毒、致癌”。那么,三者之间到底存在怎样的定义界定和试验类型划分,在此分别对三类试验进行细述。
1
遗传毒试验
依照ICH“S2(R1):人用药物遗传毒性试验和结果分析指导原则”,遗传毒性试验可定义为用于检测通过不同机制诱导遗传性损伤的化合物的体外和体内试验。PS:遗传毒性试验主要用于致癌性预测。
以基因突变、较大范围染色体损伤或重组形式出现的DNA损伤的固定,通常被认为是可遗传效应的基础,并且是恶性肿瘤多阶段发展过程的环节之一。染色体数目的改变也与肿瘤发生有关,并可提示生殖细胞出现非整倍体的可能性。
ICH指导原则对于遗传毒试验的要求,标准组合应具备以下基本特征:(1)以一项细菌回复突变试验评价致突变性。该试验已显示能检出相关的遗传学改变,以及大部分啮齿类动物和人类的遗传毒性致癌剂。(2)还应以哺乳动物细胞体外和/或体内试验评价遗传毒性。
表1.1 标准试验组合的两种选择
 (PS:标准试验组合的调整不在此赘述)
(PS:标准试验组合的调整不在此赘述)
另,遗传毒性试验组合(包括体内和体外试验)检测的是主要通过直接的遗传损伤机制的致癌剂,如大多数已知的人类致癌剂。因此,这些组合不期望用于检测非遗传毒性致癌剂。
同时,还需注意,虽然体外试验阳性结果可提示药物内在的遗传毒性特征,但是,在大多数情况下,恰当的体内试验才能确定这些体外试验阳性信号的生物学意义。但,体内遗传毒性试验也具有给出误导性假阳性结果的可能性,而该结果并不提示具有真正的遗传毒性,如:1)未给予任何遗传毒性物质,但由于干扰了红细胞生成而导致微核率升高;2)DNA加合物数据应根据内源性加合物的已知背景水平进行解释;3)与毒性相关的间接作用可能影响DNA链断裂试验的结果(如碱洗脱和彗星试验)。
2
生殖毒试验
依据ICH指导原则“S5(R3)_人用药物生殖与发育毒性检测”、“S5药品的生殖毒性和雄性生育力毒性检测”,非临床生殖与发育毒性(DART)试验的目的是揭示与人类风险评估相关的药物对哺乳动物生殖的影响。在适当的情况下,所进行的一组试验应包含对一个完整生命周期(即从第一代的受孕至下一代的受孕)的观察,并可检测即时和潜在的不良影响。
表2.1 评估生殖的阶段&“三段”划分
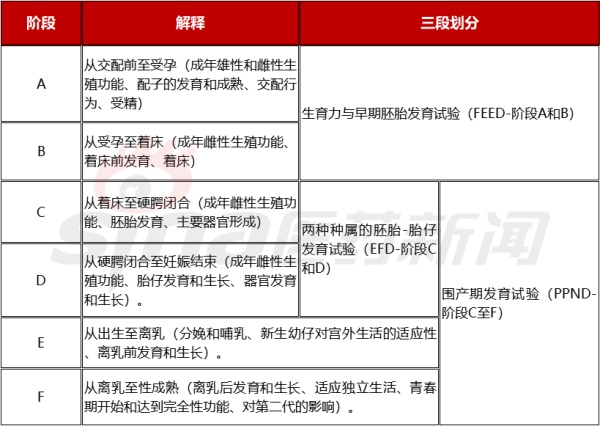
在以上试验分期的基础上,为了制定全面的综合试验策略,还需要考虑很多因素,如目标患者人群和使用条件(特别是与生殖潜力和疾病严重程度有关的);拟用于人的药物剂型和给药途径;毒性相关资料(也包括体外、离体和非哺乳动物试验的资料,以及结构-活性关系)、药效学、药代动力学,以及与其它药物的药理学相似性;药物靶点的一般生物学信息,或靶点在生殖或发育中的已知作用。具体如下表所示。
表2.2 生殖试验制订的相关因素
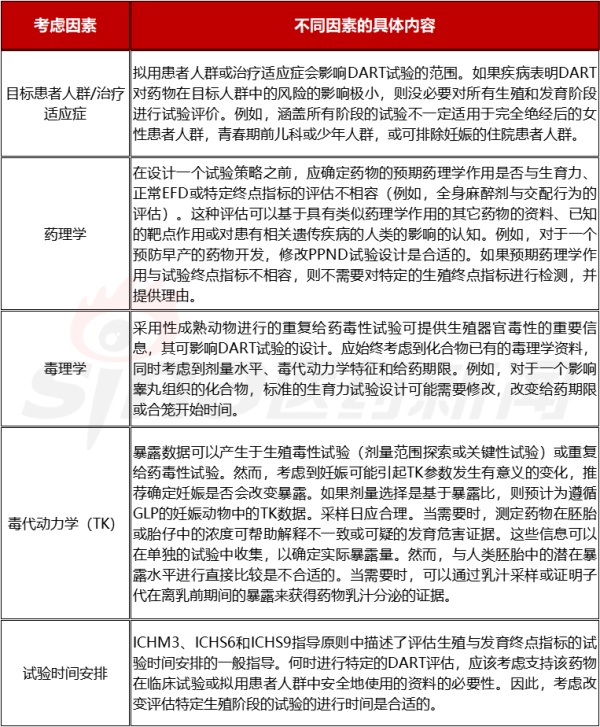
在上述需要综合考虑试验策略的基础上,还需要进一步的对各个阶段进行试验策略的细分。
➣ FEED-阶段A和B
给药期限至少两周的重复给药毒性试验的结果通常可以用于设计生育力试验,而无需进行进一步的剂量范围探索试验,尽管如此短期限的试验不足以揭示所有的不良影响。
➣ EFD-阶段C和D
对于大多数小分子药物,通常在两种动物种属(即啮齿类动物和非啮齿类动物(通常是兔))中评价对EFD的影响;至少一种实验动物种属应显示出预期的药效学(PD)效应。
➣ PPND-阶段C至F
啮齿类动物常用于PPND的评价;但是当合适时也可以使用其它种属。在大多数情况下,没有必要进行初步(剂量范围探索)的PPND试验,因为通常可以从先前的试验中获得适当的信息。但是,在离乳前或离乳时终止幼仔的初步PPND试验可用于剂量选择,或为试验设计提供信息和/或提供幼仔暴露数据。
除了上述试验分期中的介绍,还是得细述一下试验剂量的选择。根据指导原则,有许多剂量选择的终点可用于DART试验。剂量选择应考虑前期试验(例如重复给药、TK和DRF(耐受性/剂量范围)等)中的观察结果。某些情况下,少于三个剂量也足以为风险评估提供必要的信息。基于不同终点的剂量选择依据如下所示。
表2.3 基于不同终点的剂量选择依据

3
致癌试验
依据ICH“S1A:药物致癌性试验必要性指导原则”、“S1B:药物致癌性试验”、“S1C(R2):药物致癌性试验的剂量选择”,致癌性试验的目的是在动物中识别潜在致癌作用,从而评价人体中的相关风险。
由于致癌性试验耗时耗力,只有当人体暴露情况确实需要动物终生给药研究信息来评价其潜在致癌性时,才进行致癌性试验。
表3.1 开展致癌试验的临床用药周期依据
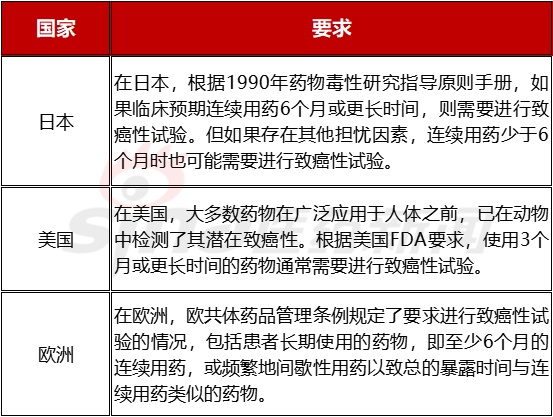
确定药物是否需进行致癌性试验的基本考虑是患者的最长用药时间及其他研究所出现的任何担忧因素,也可能会考虑其他因素,如拟用患者人群、与潜在致癌性有关的前期研究结果、系统暴露程度、与内源性物质的异同、适当的试验设计及与临床开发进程对应的试验时间安排等。
表3.2 致癌性试验应考虑的因素

只有在获得某些关键信息后,才能制定用于检测药物潜在致癌性的试验策略。这些信息包括:遗传毒性结果、拟用患者人群、临床用药方案、动物和人体药效学(选择性、剂量-反应关系)和重复给药毒性试验结果。如果在任何种属动物(包括非啮齿类)中进行的重复给药毒性试验提示受试物具有免疫抑制作用、激素活性或其他被认为对人体是一种危险因素的活性,那么这种信息就应在进一步评价潜在致癌性的试验设计中予以考虑。
基本方案包括一项长期啮齿类动物致癌性试验(建议使用大鼠),加另一项“附加体内致癌性试验”作为长期致癌性试验的补充,并提供长期致癌性试验不易得到的其他信息。PS:附加体内致癌性试验,包括“短期或中期啮齿类动物体内试验系统&第二种啮齿类动物长期致癌性试验”。
另,还是剂量的问题。通常,化学药物致癌性试验高剂量的选择常以最大耐受量(MTD)为标准(但不超过每天1000mg·kg-1),而MTD通常是基于3个月毒性试验获得的数据。PS:药物致癌性试验高剂量选择的六个标准:最大耐受剂量、25倍AUC比值(啮齿类动物:人)、剂量限制性的药效学作用、吸收饱和、最大可行剂量及限制剂量。
表3.3 理想情况/剂量产生的暴露量

最后,针对致癌试验,我们来说说如何对结果进行判定。结果无外乎两种,阴性&阳性,阴性有哪些前提?阳性有哪些具体特征,总结见下表。
表3.4 阴性前提&阳性判定

4
小结&小感
综上,即为创新药有关遗传毒、生殖毒、致癌试验研究的大体体现。客观的讲,短短的几千字不足以概括出三个试验的精髓,尤其是具体问题具体分析+不同学科之间的数据汇总解读。但,没有办法的是,创新药总项目负责人必须对每个子学科都有一定的了解乃至深入;过程中需要对每个数据进行判定,需要对每个结果进行客观分析,否则,很难把控创新药的研发节奏以及走势。所以,当上述三个毒性试验出现阳性结果时,如何判定,如何解决,并客观理性的推动项目,才是创新药研究人员真正的研究能力之所在。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}