被忽视了半个世纪,这一抗癌理念如今能攻克最具挑战的癌症靶点吗?
基于这些基因对开发的候选疗法很多已经接近进入临床开发阶段,靶向聚合酶θ(POLQ)、USP1、PKMYT1、PRMT5、MAT2A、WRN等靶点。
2022-07-27 09:29
浏览 4473 ·
评论 0 ·
点赞 44 ·
分享 21
1922年,哥伦比亚大学的遗传学家Calvin Bridges在研究果蝇杂交时发现了一个有趣的现象:同时携带两个特定基因突变的果蝇无法存活,而其中任何一个基因单独突变却不会给果蝇带来致命伤害 。20多年后,他的同事Theodore Dobzhansky在另一种果蝇中发现了类似现象,并且将其正式命名为合成致死(synthetic lethality)。
他们不知道的是,这一科学现象在超过半个世纪后,催生了重磅抗癌药物的诞生 ,如今利用合成致死的理念开发抗癌疗法,已经成为攻克肿瘤学领域最难于靶向的癌症靶点的有力策略。在合成致死现象发现100周年之际,本文将结合公开资料,与读者分享合成致死抗癌疗法开发的过去、现在和未来。
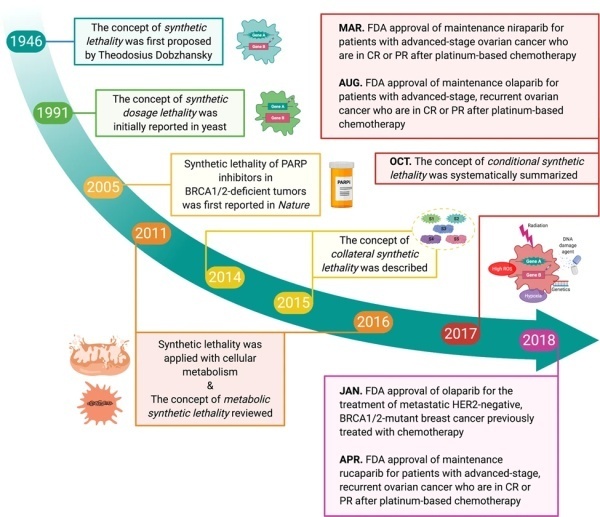
▲ 合成致死领域发展的部分里程碑(图片来源:参考资料[2])
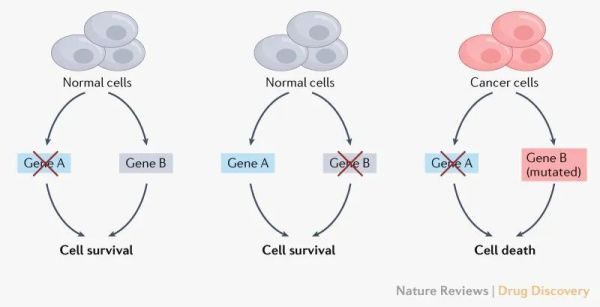
虽然合成致死的现象早在100年前被发现,但是它在抗癌药物开发方面的重要性一直没有得到重视。 在被忽视了超过半个世纪之后,Stephen H. Friend博士和他在弗雷德哈钦森癌症研究中心的同事联合在顶级科学杂志《科学》上发表开创性论文,提出合成致死可能为抗癌药物开发提供新的策略 。 在他们看来,癌细胞携带着大量的基因突变,这些基因突变让它们与健康细胞相比具有不同的特征,同时也可能产生独特的弱点。能够与癌症相关的基因突变产生合成致死相互作用的基因提供了优秀的治疗靶点。
2005年,英国两支独立研究团队在科学期刊《自然》上首次证实了PARP抑制剂与BRCA 1/2 突变之间存在着合成致死的相互作用。 人体的细胞每天都会经历成千上万次DNA损伤。它们可以分为单链和双链DNA损伤。人体也有着高度精密和有效的DNA修复机制。PARP主要负责对单链DNA损伤的修复,而BRCA主要通过利用同源重组,修复双链DNA断裂。 很多癌症细胞中存在的BRCA 基因突变导致BRCA功能的失活,这一变异可以提高癌细胞基因组的突变频率,潜在增加其适应性,然而也意味着如果PARP蛋白同时受到抑制,癌细胞的基因组可能因为积累了过多的突变,导致细胞的死亡。而健康细胞因为BRCA功能正常,反而不会因为PARP蛋白受到抑制而死亡。
▲ 合成致死用于治疗癌症的理念(图片来源:参考资料[1])
基于这一突破性研究,在2014年,阿斯利康(AstraZeneca)开发的PARP抑制剂奥拉帕利(olaparib,英文商品名Lynparza)获得美国FDA的批准,成为首款上市的PARP抑制剂,用于治疗携带BRCA 突变的晚期卵巢癌 。如今,奥拉帕利已经获批治疗携带BRCA 突变的乳腺癌、胰腺癌、前列腺癌,展现出成为重磅药物的潜力。其它PARP抑制剂niraparib、talazoparib和rucaparib也获得FDA的批准,为合成致死概念的临床应用提供了更多验证。 PARP抑制剂开发的成功,也激励研究人员探索其它的合成致死相互作用。然而,寻找合成致死基因对的工作并不容易,因为合成致死的基因对相对罕见,找到它们需要对人类基因组进行大规模的筛选。什么样的工具能够让科学家们快速有效地研究人类基因组中的每一个基因对癌细胞生存的影响呢?
近年来,赫赫有名的CRISPR基因编辑技术打开了合成致死研究的新篇章。这一被称为“基因魔剪”的编辑工具能够在基因组的任何制定位点切开DNA分子,对DNA序列进行修改。利用它开发的 CRISPR筛选技术给研发人员提供了系统性敲除单个基因表达的有力手段 。它通过基因编辑可以导致基因的完全失活,具有高度特异性,大幅度提高了合成致死研究的效率。
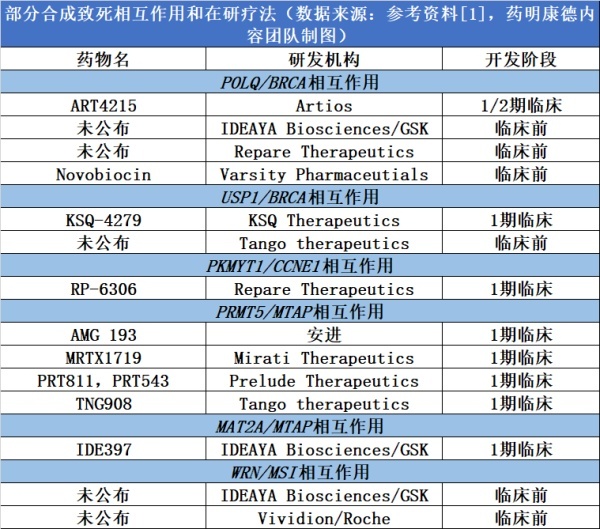
通过对上百种不同的癌症细胞系,利用CRISPR筛选技术系统性地敲除每一个基因,研究人员已经发现了多个合成致死基因对,基于这些基因对开发的候选疗法很多已经接近进入临床开发阶段,靶向聚合酶θ(POLQ)、USP1、PKMYT1、PRMT5、MAT2A、WRN等靶点。
▲ 部分合成致死相互作用和在研疗法(数据来源:参考资料[1],药明康德内容团队制图)
其中,多个合成致死靶点与DNA损伤修复通路相关。比如,PARP抑制剂虽然对携带BRCA 基因突变的癌症患者产生出色的疗效,但是很多患者在接受治疗之后,对PARP阻断产生耐药性。这意味着需要发现新策略来克服耐药性。多项研究发现,产生PARP耐药性的肿瘤细胞对聚合酶θ 抑制剂尤为敏感。这一发现促进了聚合酶θ 抑制剂和蛋白降解剂的开发。 新发现的合成致死基因对也已经扩展到DNA损伤修复通路以外的信号通路。 比如,PRMT5与MTAP之间的合成致死相互作用源于MTAP缺失导致癌细胞的蛋氨酸代谢异常,让这些细胞对PRMT5抑制剂尤其敏感。
在获得更多可以靶向的合成致死靶点的同时,新药开发人员也需要面对不同的挑战,很多合成致死靶点不是可以用传统小分子抑制剂抑制的蛋白激酶,这意味着科学家们需要使用其它方法来有效抑制这些靶点的功能。靶向蛋白降解技术正在成为合成致死药物开发领域的一种新兴技术。与传统小分子抑制剂相比,它导致靶点蛋白水平的下降,更有效地模拟CRISPR筛选时基因敲除的结果。 比如,IDEAYA Biosciences就在开发一款针对Polθ的蛋白降解剂。
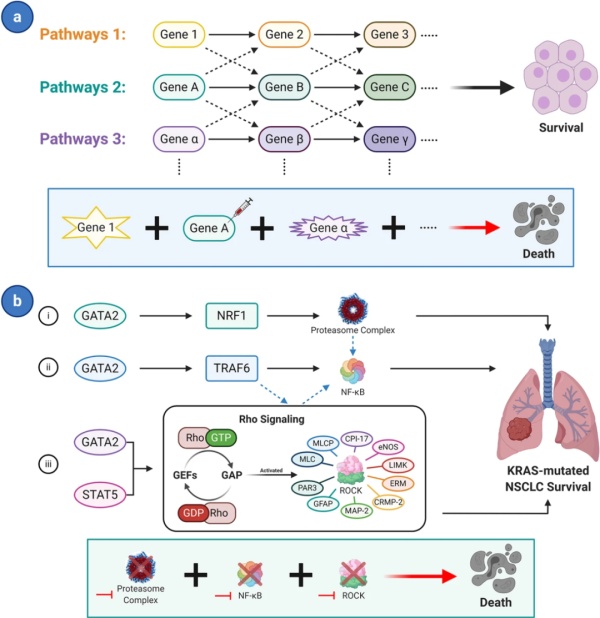
随着高通量筛选技术的进步,科学家们已经将眼光放在了由多重基因构成的合成致死关系 。在很多情况下,癌细胞依靠多条功能重叠的信号通路保障细胞的生存和增殖。这些冗余的信号通路让抑制一条或者两条信号通路无法对细胞生存产生影响。比如KRAS 基因驱动的非小细胞肺癌依靠三条GATA2转录因子介导的下游通路和它们之间的交流维持细胞的生存,只有同时抑制这三条信号通路才能导致细胞的死亡。
▲ 依靠多条信号通路构成的合成致死关系(图片来源:参考资料[4])
科学家们已经在开发发现这种更复杂的相互作用关系的筛选工具,比如旁系同源蛋白敲除(paralogue knockout)是一种利用CRISPR技术,敲除与靶点蛋白具有类似功能的蛋白家族其它成员的技术。 敲除一个蛋白家族成员可能不会导致癌细胞的死亡,但是敲除几个家族成员可能让合成致死相互作用显现出来。比如,Broad研究所的团队去年发表的论文发现同时敲除DUSP4 和DUSP6 与NRAS 和BRAF 突变构成了合成致死关系 。 在分析多重信号通路构成的合成致死关系方面,人工智能和机器学习将大有用武之地 ,基因泰克的研究和早期开发负责人Aviv Regev博士表示。“这是让我痴迷的事,”她说,“有太多技术我们可以利用。” 100年前,合成致死现象首次在果蝇中被发现,彼时没人能预想到一个世纪后,合成致死的理念对抗癌疗法的开发产生如此深远的影响。在抗癌药物开发领域,最难于靶向的一类靶点是一系列因为基因突变导致功能丧失的抑癌基因,比如著名的TP53 。因为当突变蛋白的功能丧失,或者完全不表达之后,很难使用小分子药物恢复它们的功能。而近年来的基础研究和临床开发成果显示,合成致死提供了靶向这些功能丢失突变的有力策略 。期待这一领域的进一步发展帮助科学家们攻克这些难于靶向的靶点,造福更多癌症患者。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。



{replyUser1} 回复 {replyUser2}:{content}