先天性代谢疾病(以下简称“代谢疾病”)是由代谢过程中的酶缺陷引起的异质性遗传疾病,导致代谢功能障碍或有毒中间代谢物的积累。根据科学研究,已有1000多种不同的代谢疾病被发现,虽然绝大多数为罕见病,但其累计发病率估计高达1/800,按世界人口80亿计算,患病人数可达1千万。已有的一些标准治疗包括酶替代疗法、细胞/器官移植及其他支持性疗法等。但这些疗法如酶替代疗法对大脑或无血管软骨的影响有限,需要长久接受输注治疗,患者存在着极大的未满足需求。
针对代谢疾病致病基因的新型疗法,如RNA疗法、基因疗法等在逐渐取得新的突破,有望为这一领域带来新的治疗希望。近日该领域迎来三个重磅消息。8月3日,Alnylam宣布siRNA疗法patisiran治疗伴有心肌病的转甲状腺素蛋白介导的淀粉样变性(ATTR-CM)患者的3期临床试验中达到主要终点。7月21日,欧盟委员会批准蓝鸟生物的一次性给药基因疗法elivaldogene autotemcel上市,用于治疗18岁以下携带ABCD1基因突变的早期脑性肾上腺脑白质营养不良患者(CALD),这是全球首款用于CALD患者的基因治疗。同日,欧盟委员会批准基因疗法Upstaza(eladocagene exuparvovec)上市。用于治疗18个月以上芳香族L-氨基酸脱羧酶缺乏症(AADCD)患者。这是直接注入大脑的首款获批基因疗法。基因疗法从原理上可以引入基因来产生正常酶蛋白,替代缺失或有缺陷的酶蛋白,因而逐渐成为代谢疾病领域的重要治疗方式。在今天的这篇文章里,药明康德内容团队将结合全球代谢疾病领域基因疗法的在研管线分析,为您介绍未来一到十年内该领域有望发生的重大进展。- 未来一年将有23款代谢疾病基因疗法有望获得里程碑进展(获批、递交监管申请或取得临床进展)
- 代谢疾病基因疗法患者受益群体扩大:相较于临床阶段,临床前阶段基因疗法覆盖疾病种类多出约20种,甘露糖苷病、脂蛋白脂酶缺乏等疾病患者未来有望受益于基因疗法
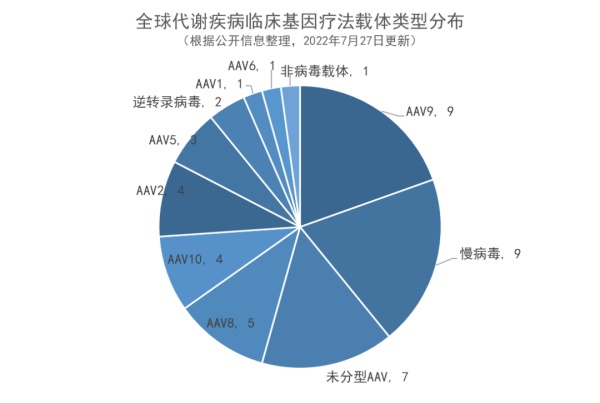
- 腺相关病毒(AAV)在代谢疾病基因疗法载体中占据主要地位(74%),可穿过血脑屏障的AAV9载体最多;创新AAV载体的开发涌现
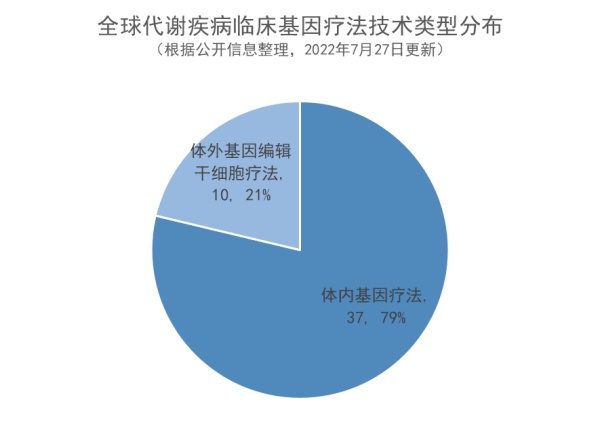
- 体内基因疗法占代谢疾病临床管线主流:体内基因疗法在代谢疾病临床管线中占79%,技术创新不断进行中
注:本文讨论的基因疗法通过引入功能基因以纠正或补偿缺陷和异常基因引起的疾病。包含体内基因疗法(直接将治疗基因递送到患者病患部位)和体外基因疗法(将特殊细胞例如干细胞进行基因工程改造后移植入人体)。今年有14款代谢疾病基因疗法已发生临床积极进展,详情请见下表。
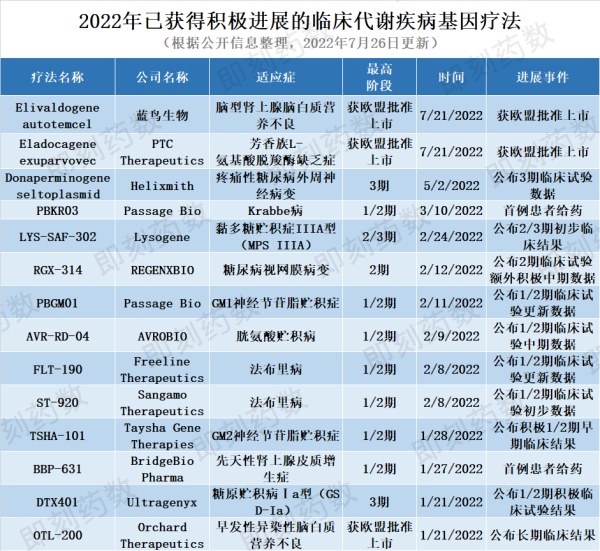
▲2022年已获得积极进展的临床代谢疾病基因疗法(图片来源:药明康德内容团队制图)未来一年有23款代谢疾病基因疗法有望获得里程碑进展(获批、递交监管申请或取得临床进展),我们将重点介绍三款具有技术创新性的疗法。药物名称:bevufenogene nofeparvovecHomology Medicines正在进行开发的bevufenogene nofeparvovec是一种基于腺相关病毒载体AAVHSC的基因疗法,用于治疗苯丙酮尿症(PKU)。PKU是一种罕见的先天性代谢异常,由PAH基因突变引起,导致苯丙氨酸羟化酶失去功能。该酶负责苯丙氨酸的代谢。如果不及时治疗,苯丙氨酸会在血液中聚集并导致神经功能障碍。目前该疗法已被FDA授予孤儿药资格和快速通道资格,预计2022年第三季度更新2期试验数据。该疗法使用高效率递送载体AAVHSC15进行基因递送。作为新型载体,AAVHSC系列载体具有独特结构和功能。
图片来源:Homology Medicines官网
公司名称:LogicBio TherapeuticsLogicBio公司的LB-001是一款潜在“first-in-class”基因编辑疗法,使用该公司独有的GeneRide技术平台。这一平台利用细胞自身的同源重组DNA修复机制,不需要使用外源核酸酶,就能完成对基因组的精准编辑。这一策略可能降低疗法的免疫反应和致癌风险。LB-001利用AAV载体,将表达甲基丙二酰辅酶A变位酶(MMUT)的转基因精准插入到肝细胞的白蛋白基因位点。MMUT基因突变是导致甲基丙二酸血症最常见的原因。它导致毒性代谢产物在肝脏、肌肉和大脑中聚集,造成组织损伤和发育延迟。值得一提的是,LogicBio新闻稿显示,其1/2期初步结果是首次显示在儿童体内成功基因编辑的临床试验结果。公司预计将在今年第三季度将在临床试验中给药下一位患者。公司名称:4D Molecular Therapeutics4D Molecular Therapeutics(4DMT)开发的4D-310,是一种静脉输注的基因疗法,用于治疗法布里病。去年10月,4DMT公布了该疗法的1/2期中期积极试验结果。该新闻稿指出,这是首次临床试验显示,单剂基因疗法能够在这一难以治疗的法布里病患者群体中将α-半乳糖苷酶A(AGA)活性提高到接近或高于正常水平。该公司预计将在2023年上半年提供临床更新数据。法布里病是一种X连锁遗传病,因为基因突变,导致溶酶体中的AGA活性缺失,毒性代谢产物在血管、肾脏、心脏、神经和其它器官中积聚,最终导致慢性肾病、肾衰、心血管病和卒中。4D-310由4DMT公司的平台开发的C102衣壳携带表达AGA的GLA基因。C102衣壳经过特定的优化,提高了它转染心肌细胞的能力,可通过静脉输注用于治疗心肌疾病。其余有望获得临床开发里程碑进展的代谢疾病基因疗法请见下图。
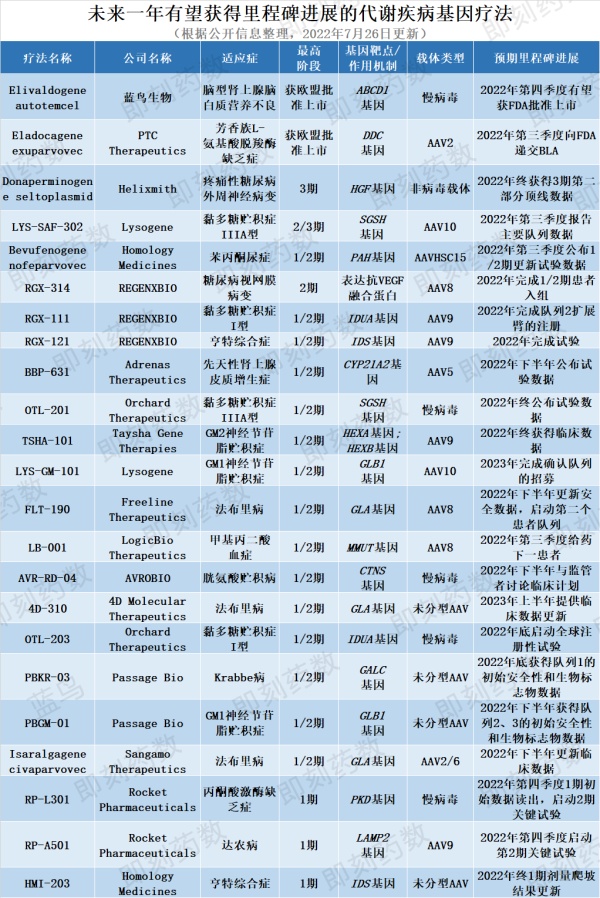
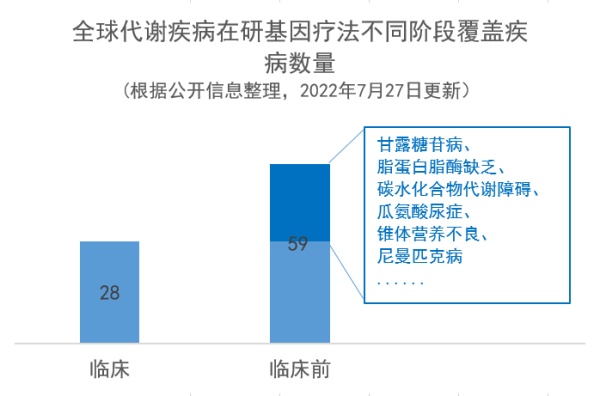
▲未来一年有望获得里程碑进展的代谢疾病基因疗法(图片来源:药明康德内容团队制图)通过对目前临床阶段和临床前代谢疾病基因疗法覆盖的疾病种类进行分析,临床阶段覆盖的疾病种类主要集中在代谢罕见病,如GM1神经节苷脂贮积症、腺苷脱氨酶缺乏症、粘多糖贮积症ⅢA型等,共覆盖28种疾病。代谢疾病在研基因疗法在临床前阶段覆盖的疾病为59种,其中,甘露糖苷病、脂蛋白脂酶缺乏等疾病尚未有临床阶段基因疗法,未来这些疾病患者有望从基因疗法中获益。M6P Therapeutics开发的针对甘露糖苷病的基因疗法M-063使用慢病毒递送LAMAN基因。甘露糖苷病是一种多系统性进行性疾病,患者表现具有高度异质性。Precision Biosciences与宾夕法尼亚大学合作,正在研究一种AAV8递送的特异性核酸酶,该酶可切割APOC3基因外显子中的靶点,用于脂蛋白脂酶缺乏症的治疗。脂蛋白脂肪酶缺乏症是一种罕见的常染色体隐性遗传疾病,其特征是LPL基因中的功能缺失突变,导致无法产生功能活性的脂蛋白脂肪酶。基因疗法的一大挑战和核心是递送方式,由于代谢疾病多累及身体多系统器官,因此,递送载体的设计至关重要。根据对载体类型的分析,AAV在代谢病基因疗法载体递送中占据主要地位,占比约为74%。AAV为主要递送载体的主要原因为它的免疫原性很低,不会引起严重的免疫反应,同时几乎没有对人的致病性,因此安全性较高。同时,不同血清型的AAV载体对不同组织和细胞的转染效率不同,选择合适血清型的AAV载体为实现对不同组织器官的精准递送提供了可能。将递送AAV按照血清型进行细分,发现,AAV9是AAV中重要的递送方式,占总体载体数量比例约为20%。AAV9在治疗代谢疾病的治疗开发方面占据主要地位的部分原因为:它可以穿越血脑屏障以靶向中枢神经系统。代谢疾病中许多疾病会导致神经系统受累,如黏多糖贮积症I型、IIIA型、糖原贮积病等。传统酶替代疗法的药物由于血脑屏障的存在对于中枢神经症状无效。基因疗法能否通过血脑屏障,也成为其疗法开发的重点之一。
新型的可穿透血脑屏障的载体也在被不断开发中,例如上文中提及的Homology Medicines公司开发的AAVHSC系列产品,彼此间有着1-4个氨基酸的结构差异,这也导致不同产品的体内分布和转导效率的差异。该系列之一的AAVHSC16载体与AAV9相比,具有显著降低的肝脏嗜性,给药后不引起肝酶升高,对中枢神经系统具有高组织嗜性,因此有望成为这一领域的重要递送方式之一。今年7月8日,其系列产品之一临床前研究数据在Molecular Therapy-Methods & Clinical Development期刊上发表。其他针对AAV衣壳创新设计能力也是未来基因疗法开发的重点之一,上文中已经有过疗法介绍的4DMT的AAV发现平台称为“Therapeutic Vector Evolution”,通过创建多样化合成AAV衣壳序列,可以从包含10亿个不同AAV衣壳蛋白的文库中筛选出为特定疾病“量体裁衣”的AAV载体衣壳。它们不但具有更高的组织特异性,而且不会受到患者体内中和抗体的影响,在递送基因方面也更为安全。对代谢疾病临床基因疗法中使用的技术进行分析,发现,体内基因疗法占代谢疾病基因疗法临床管线主流,临床阶段疗法数量占比达79%。体内基因疗法作为代谢疾病领域的主要疗法,其创新仍在不断进行中。例如,LogicBio Therapeutics公司的体内基因疗法LB-001,已进行至临床1/2期阶段。该公司利用同源重组技术,可以在不使用外源核酸酶的情况下,利用细胞天然的DNA修复过程,在体内完成基因编辑,避免其他基因疗法和基因编辑方法产生的相关风险。免疫系统相关代谢疾病更适合使用体外基因编辑干细胞疗法,如腺苷脱氨酶缺乏症;而针对累及神经系统的疾病,体内基因疗法则被应用更多,如GM1、GM2神经节苷脂贮积症。值得一提的是,针对某些代谢疾病,体内或体外基因疗法都在临床开发中,如黏多糖贮积症(MPS)。MPS被认为是基因疗法的适宜目标原因有两个:它是单基因遗传病、少量正常功能的酶可以改善体细胞和神经系统病变。体内基因疗法是MPS的主要基因疗法。为了有效地将药物递送至大脑,MPS体内基因疗法采用脑内注射、鞘内注射等特殊给药方式,系统性全身注射则会采用上文中已提到的特殊设计的AAV以穿越血脑屏障。克服血脑屏障造成的障碍对于体外基因编辑干细胞疗法挑战更大,已有的研究结果显示,体外基因编辑干细胞疗法虽然可显著降低MPS IH患者的发病率并提高他们的生活质量,但对于骨骼和中枢神经系统的治疗效果依然有限,因此相关疗法的开发存在极大的挑战。总结而言,基因疗法作为一种有望“一次治愈”的治疗方式,为代谢疾病患者群体带来了治疗希望。希望未来能有更多基因疗法被开发用于治疗此领域疾病,解决患者未满足的治疗需求。





{replyUser1} 回复 {replyUser2}:{content}