日前,一张来自行业媒体BioCentury的图片在朋友圈里传开,引起广泛关注。这张图总结了细胞疗法、基因疗法、抗体偶联药物等新兴的新分子治疗模式,自2011年以来的获批趋势。趋势表明这些全新类型疗法问世的速度正不断加快,更好地造福全球病患。
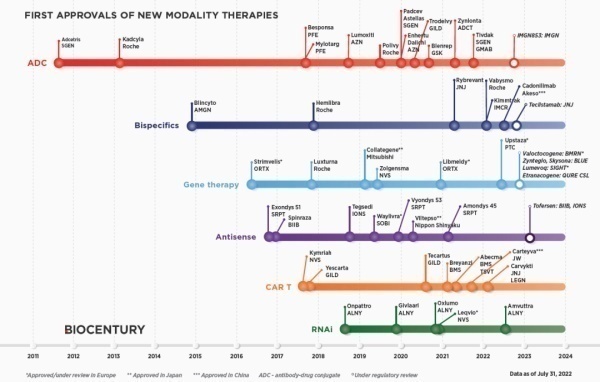
仔细分析这张图,可以看到很多情况下,新分子治疗模式的首款疗法获批之后,通常会出现一个空窗期,然后在第二个突破产生,打破新分子治疗开发的技术瓶颈后,后续药物获批的速度明显加快。这在抗体偶联药物(ADC)中得到很明显的体现。抗体偶联药物将具有细胞毒性的化合物与靶向癌细胞的抗体偶联在一起,目的是将细胞毒性药物选择性地递送到肿瘤细胞中,在发挥抗癌作用的同时,又避免对健康细胞的影响。早在2000年,首款ADC疗法Mylotarg就获得FDA加速批准上市,用于治疗急性髓系白血病患者。然而由于毒副作用,它在获批10年之后退市。抗体偶联药物的开发也一度陷入沉寂。这是因为,这个概念看似简单,但是在实际操作中面临多重挑战。其中将细胞毒性药物与抗体偶联在一起的连接子的作用至关重要。
如果连接子太早释放药物,就会在血液中产生脱靶毒性;如果在靶细胞区域不能够有效释放载荷药物,又会影响对癌细胞的杀伤作用。因此,一个优秀的连接子要做到,对于载荷药物“不该释放时绝不放手,该释放时当机立断”。
近年来,业界投入了大量的研发精力和资源用于优化抗体偶联药物的结构。随着关键技术的突破,抗体偶联药物终于破茧成蝶,接连获批。
双特异性抗体的开发也需要面对疗法稳定性、递送模式和制造工艺方面的挑战。首款获批的双特异性T细胞衔接蛋白Blincyto需要患者长时间持续接受静脉输注。随着双特异性抗体结构设计的完善,具有更长半衰期的双特异性抗体疗法不断出现,已经有上百款双抗疗法进入临床开发阶段。
这些新分子治疗模式问世速度的加快,不但得益于研发瓶颈方面的突破,也体现了它们在治疗疾病上的优势。新分子治疗模式在治疗疾病方面上的优势体现在多个方面。首先,它们可以用于靶向传统治疗模式无法靶向的靶点,比如基因疗法,反义寡核苷酸(ASO)和RNAi疗法治疗的疾病中,致病基因突变虽然已经被发现很久,但是它们无法用传统小分子或者抗体疗法进行靶向,新治疗模式提供了靶向这些靶点的新手段。即便是针对可以被传统治疗模式靶向的靶点,新治疗模式也可以提供更安全、有效、造福更多患者的疗法。这在HER2靶向疗法上得到充分的体现,靶向HER2的多款ADC表现出卓越的疗效。近日,阿斯利康和第一三共联合开发的Enhertu首次给HER2低表达的乳腺癌患者提供了HER2靶向治疗选择。其次,多种新分子治疗模式具有可编程的模块式设计方式,这意味着随着技术平台的成熟,它们可以在较短的时间里根据不同的靶点,替换疗法设计中的模块,迅速开发出具有针对性的疗法。比如RNAi疗法和ASO疗法都通过与mRNA序列的互补结合来产生治疗效果。只要改变寡核苷酸的序列,就可以针对不同的靶点,开发出全新的疗法。在今年的药明康德全球论坛上,Laronde公司首席执行官Diego Miralles博士表示,这种可编程的疗法开发是提高生物医药产业研发效率的重要驱动力之一。这些可编程的新治疗模式,也给罕见病患者带来了希望。很多罕见病是由于基因中出现了罕见的基因突变,它们的患者人数稀少,甚至世界上只有一名患者。ASO疗法可以通过与特定RNA结合,防止有毒蛋白的表达,或者改变mRNA的剪接,生成具有功能的蛋白。致力于开发ASO疗法的Ionis公司创始人Stanley T. Crooke博士已经成立了n-Lorem基金会,与学术机构和行业合作伙伴携手开发治疗超级罕见病患者的个体化ASO疗法。
细胞疗法和基因疗法还提供了通过一次性治疗,“治愈”疾病的可能性。今年,首位接受CAR-T疗法治疗的儿童患者Emily Whitehead已经10年无癌了。今年在学术期刊《自然》上发表的论文中,全球知名CAR-T疗法专家Carl June教授领衔的团队发现,接受CAR-T治疗的两名成人患者也已经10年无癌。他表示:“基于这些结果,我们现在能总结说,CAR-T疗法真的可以治愈癌症患者。”
近日获得欧盟批准的基因疗法Upstaza的临床试验数据也显示,接受一次治疗后,患者的运动和认知功能改善可以持续10年之久。它们让“一次治疗,终身获益”的理想成为可能。目前,多款双特异性抗体疗法处于3期临床开发阶段,不少双特异性抗体已经进入监管审评阶段,有望近日获得批准。比如,杨森公司的双特异性抗体Tecvayli(teclistamab)已经获得欧洲药品管理局的人用药品委员会(CHMP)的推荐,有条件上市用于治疗复发/难治性多发性骨髓瘤。罗氏的Lunsumio(mosunetuzumab)已在欧盟获得批准,今年年底之前有望获得美国FDA的批准。艾伯维也计划在今年递交与Genmab合作开发的双特异性抗体疗法epcoritamab的上市申请。在基因疗法方面,未来一年中多款疗法可能获批上市,包括用于治疗Leber遗传性视神经病变的Lumevoq(lenadogene nolparvovec),治疗β地中海贫血的betibeglogene autotemcel,治疗血友病B的etranacogene dezaparvovec,治疗血友病A的valoctocogene roxaparvovec等。更多的新分子治疗模式也在不断涌现,比如CRISPR基因编辑作为摘得诺奖桂冠的突破性发现,催生的体外基因编辑疗法CTX001有望今年递交监管申请,成为首个获批的基因编辑疗法。Intellia Therapeutics开发的体内编辑疗法也已经表现出治愈潜力。mRNA技术在新冠疫苗开发领域获得成功之后,正在扩展到其它传染病和肿瘤学领域。全球的监管机构也认识到新分子治疗模式的潜力,并就其开发提供了多重指导和加速开发措施。比如,日前欧盟发布的优先药品(PRIME)认定5年分析报告显示,包含基因疗法和细胞疗法在内的先进治疗药物获得PRIME认定的比例最高。根据药明康德数据库的统计,最近3年里,基于新分子治疗模式的23款疗法和疫苗获得美国FDA的批准,约为2019年以前FDA批准的所有这类疗法总数的150%。这些数据显示了新分子治疗浪潮汹涌而来的趋势。期待更多创新疗法早日问世,造福广大病患。



{replyUser1} 回复 {replyUser2}:{content}