一文探究:AAV基因疗法的临床应用优势与挑战
基因治疗是目前最火热的治疗领域之一,近些年多个基因疗法已经获得监管机构的批准,一批已经进入后期临床研究的管线也正在接近获批上市。
目前大多数基因治疗应用的仍是病毒载体,这些病毒载体经过改造后,已经不具有致病性。广泛应用的病毒载体包括腺病毒载体(ADV)、慢病毒载体(LV)、单纯疱疹病毒载体(HSV)、痘病毒载体(PV)及腺相关病毒载体(AAV)。
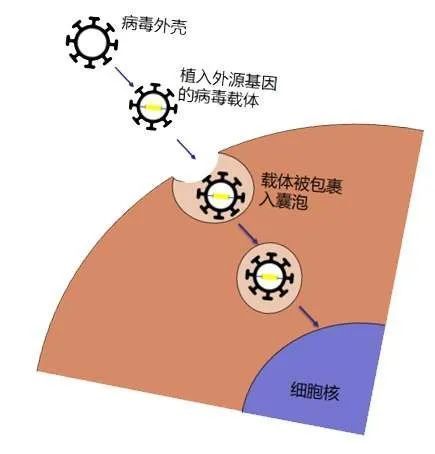
▲ 病毒载体转导过程(图片来源:公开网站)
其中AAV是目前在研基因疗法项目中应用最为广泛的病毒载体,那么AAV载体有哪些临床优势呢?目前又存在什么困难和挑战呢?
AAV属于微小病毒科,为无包膜的单链线状DNA病毒,大小约为26nm,最早在恒河猴肾细胞的培养物中首次发现。AAV的基因组约4700bp,包括上下游两个开放读码框架(ORF),位于分别由145个核苷酸组成的2个反向末端重复序列(ITR)之间。
由于腺相关病毒具有宿主范围广、安全性高、免疫原性低、表达稳定和物理性质稳定等优点,已被广泛地应用于基础研究和临床试验中, 并已成为世界上最常用的基因治疗载体之一。
AAV临床应用优势
➤ 无致病性,安全性高
相比较其他病毒载体,AAV是一种复制缺陷型的病毒,无自主复制能力,通常只有在如腺病毒或疱疹病毒同时感染细胞的情况下,才能完成复制。
在NIH对于生物技术制品的相关评级中,AAV属于RG1,即最安全等级,而腺病毒载体属于RG2,逆转录病毒载体属于RG3,目前尚未发现AAV具有致病性。
一些针对血友病A、血友病B、视网膜疾病和脊髓性肌萎缩(SMA)等疾病的临床试验已被证明AAV是安全有效的治疗工具。
➤ 免疫原性低
AAV免疫原性也显著低于腺病毒或慢病毒,体内注射后引起的免疫反应是微弱且短暂的。大剂量全身性注射,特别是尾静脉使用时,虽然也会导致微量抗体的产生,但很少有染毒细胞被细胞免疫系统所清除的现象,这被认为与AAV对抗原呈递细胞(APC)感染较弱相关。当AAV用于局部感染肌肉、脑、眼等组织时,即使进行重复感染,其效率也不会受到太大影响。
➤ 长期表达稳定
在基本不分裂的细胞中,AAV可长期稳定地表达外源基因,也不会打断宿主的其他基因。AAV表达可以半年以上,甚至有临床实验2年后仍然可以检测到其表达,这一点是其他载体所达不到的。
➤ 血清型多,有较丰富的靶向性
AAV的衣壳蛋白以二十面体的构型聚集在一起,在结构上形成刺状突起,这些突起介导与靶向细胞表面蛋白质的相互作用,赋予了不同类型的AAV特异性地靶向不同组织的能力。AAV2是20世纪60年代从腺病毒中发现的首个AAV载体。
迄今为止,已经发现了13种原发性AAV血清型和100多种不同的变异体。每种血清型都具有独特的细胞靶向性,可以靶向不同的细胞组织。
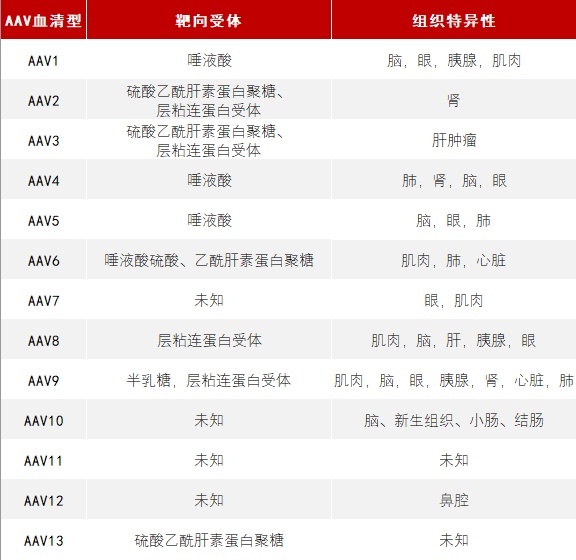
▲ 不同血清型AAV的受体及靶向目标(星耀研究院整理)
➤ 宿主范围广
AAV可以感染广泛的哺乳动物细胞,并且已成功应用于人类和非人类蛋白质的表达。和其他病毒来源的各种载体相比,已证明用于具有免疫活性细胞的基因表达时,腺相关病毒载体的效果更好。
基于以上优势,近些年来在临床实验上,AAV治疗疾病的种类有很大发展,从最初的针对于单基因遗传病[如肺囊性纤维化(CPF)和血友病B等],发展到眼部疾病、关节炎、肿瘤、肌营养不良症、神经性疾病以及血液性疾病等一系列基因缺陷病。
根据clinicaltrials.gov上的数据,截止2022年6月,全球已经进行了200多项利用AAV递送蛋白质基因的研究,70余项临床试验仍在进行中,如表中所示,占据前三的是血液疾病、神经系统疾病和视网膜病变,分别占比17.3%,13%和11.1%。
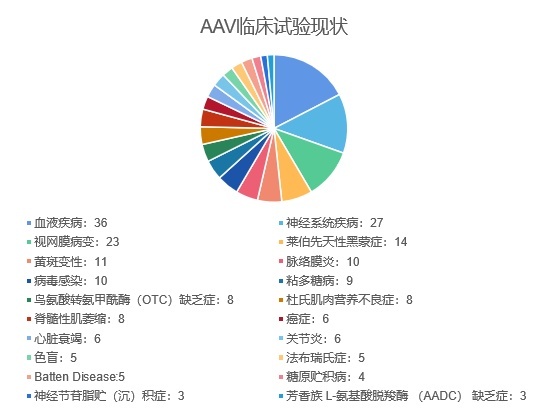
▲ AAV临床试验现状(星耀研究院制图)
AAV临床应用难点与挑战
虽然AAV载体在临床上有诸多应用优势,但依然存在一定的局限性,这也给AAV的临床应用带来挑战。
以首个获批上市的基因治疗药物Glybera为例,它使用AAV2载体将产生功能性脂蛋白脂肪酶的基因递送到患者骨骼肌,以降低患者胰腺炎的发病率,但是不能彻底治愈。Glybera针对的适应症过于罕见(发病率约为百万分之一)而且误诊率较高,由于其高昂的治疗费用和较少的市场需求,上市后只有一位患者接受了该药治疗,只得于2017年黯然退市,仅上市短短3年。
而另一家公司Solid Biosciences开发的产品SGT-001,主要针对杜氏肌营养不良症,最初使用AAV9载体,但由于首名接受治疗的患者出现了严重的副作用,FDA曾一度决定暂停该临床试验,在积极回答所有问题后,才被许可重新启动试验。
这些事例表明,虽然AAV作为基因治疗中的明星载体,拥有其他病毒载体无法比拟的优点,但临床中仍存在较多局限性,下面详细介绍一下AAV临床应用的难点与未来发展方向。
➤ 提升免疫原性和组织靶向性
免疫原性和组织靶向性都取决于AAV亚型或血清型。由于迄今为止仅有十几种AAV血清型得到了很好的描述,还有很多血清型的特性没有被很好地表征,基于AAV衣壳内的可变区域,已经区分出了数百种AAV血清型,并改变了影响免疫原性和组织趋向性的特性。
其中,尤其重要的是作为AAV受体的细胞表面聚糖,它直接受AAV可变区影响,并影响组织趋向性。因此,新的AAV衣壳生成已经成为基因治疗临床前开发的关键。
推荐阅读:超10亿美元合作开发新型AAV载体,详解AAV衣壳改造新技术
➤ 跨越免疫屏障
血脑屏障是保护中枢神经系统的一道重要屏障,但它也阻隔了药物的传递和吸收,使神经系统疾病的治疗变得困难。因此,研究人员需要找到有效突破血脑屏障的药物递送策略。
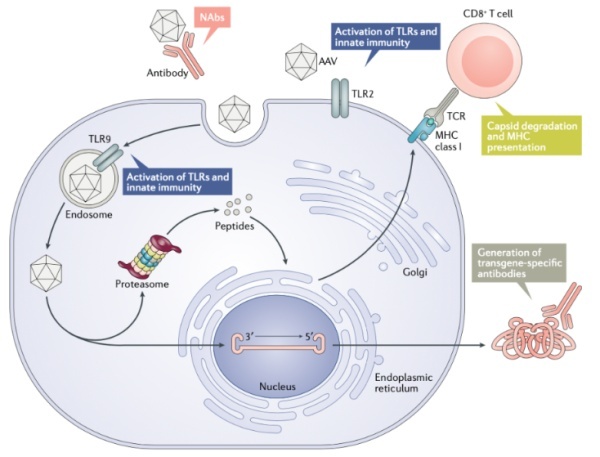
▲ 重组型AAV递送的免疫屏障(来源:公开网站)
美国加州理工学院 Viviana Gradinaru 团队在 Nature Neuroscience 期刊上发表了一篇研究论文,该团队开发了一种新型AAV变体——AAV.CAP-B10,该载体能够通过血液注射突破血脑屏障,靶向神经细胞,同时不会在肝脏富集,避免了可能引起的肝脏毒性副作用,为脑部疾病提供了一种更安全、更有效的治疗选择。【5】
➤ 优化可携带基因的限制
AAV是单链DNA病毒,基因组结构简单,全长约4.7kb。除去两端的反向末端重复序列(ITR)、启动子以及终止子,可以递送的目的基因长度约为4.5kb。
与目前依旧热门的基因治疗载体例如腺病毒(外源基因容量约37kb),逆转录病毒(外源基因容量<8kb)或者慢病毒(外源基因容量<5kb)相比,AAV的基因递送容量较小,这将导致其靶向适应症缩小到只能是那些小片段转基因的表达。
所以,研究人员需要采用一系列方法来改造AAV,通过改造病毒载体的基因结构,扩大其载体容量,才能使AAV载体更加符合不同疾病的需求。
2019 年,Bertin等对AAV2 的衣壳进行分子工程设计,通过对衣壳进行糖基化修 饰,在3个细胞系(HeLa、Huh7 和 ARPE-19)中转基因表达增加了1.3~2.5倍,糖基化位点修饰的AAV在B型血友病小鼠模型中,肝基因转移引起人凝血因子(F)Ⅸ水平增加2倍,而其T/B细胞免疫反应并未改变。【4】
➤ 降低生产成本
AAV载体规模化生产成本的控制对最终的产品定价较为关键。据Nature Reviews Drug Discovery披露,目前约有238个基于AAV的细胞与基因治疗临床试验正在开展,是临床试验中使用最多的病毒载体之一。
AAV基因治疗产品价格高昂的主要原因在于其工业化生产的多个方面未得到全面优化,如何降低成本、扩大商业化生产能力是AAV基因治疗商业化的一大难题。
➤ 扩展适应症
通过对目前临床阶段和临床前代谢疾病基因疗法覆盖的疾病种类进行分析,临床阶段覆盖的疾病种类主要集中在代谢罕见病,如GM1神经节苷脂贮积症、腺苷脱氨酶缺乏症、粘多糖贮积症ⅢA型等,共覆盖28种疾病。代谢疾病在研基因疗法在临床前阶段覆盖的疾病为59种,其中,甘露糖苷病、脂蛋白脂酶缺乏等疾病尚未有临床阶段基因疗法,未来这些疾病患者有望从基因疗法中获益。
随着研究的不断深入,AAV基因疗法的应用范围也能够得到进一步扩展,解决这一难题,可治疗患者的数量也会大大提高。
结语及展望
近日,国家发展改革委印发《“十四五”生物经济发展规划》,提出开展前沿生物技术创新,包括发展基因诊疗在内的新技术,推动形成再生医学和精准医学治疗新模式。
而AAV正处于基因治疗的前沿,全球市场上临床认可的产品相继出现,对于使用AAV载体的基因治疗,未来十年将持续改进AAV载体的设计和开发,以精准靶向,并实现低剂量的体内疗效为发展方向,从而降低AAV基因治疗的成本,并展现出更为广阔的应用前景。


{replyUser1} 回复 {replyUser2}:{content}