PROTACs作为一种新兴的治疗策略,通过劫持泛素-蛋白酶体系统降解致病靶蛋白,具有能彻底改变医药行业发展趋势的潜力。然而,目前许多PROTAC的临床之旅并不顺利,大多数PROTAC并未能度过药物开发的临床前研究阶段。这其中的原因很多,其中一个最具挑战性的障碍便是无法确保PROTAC朝向靶点的精准递送。为了能让PROTRAC早日造福患者实现其医疗价值,PROTAC更要与先进的递送系统相互结合来改善其物理化学性质、提高其靶向性并减少其脱靶的副作用。PROTAC和多功能递送系统的联合将为靶向蛋白降解领域开辟新的研究方向。
本文,我们介绍了通过各种递送系统来提高PROTAC体内降解活性的最新进展,总结了PROTAC递送系统的设计原则以及当前面临的挑战,最后展望了该领域未来的发展机遇。
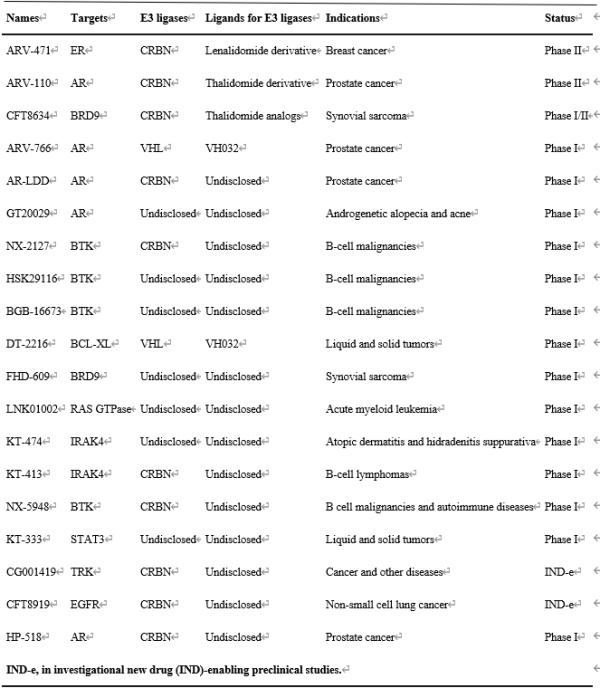
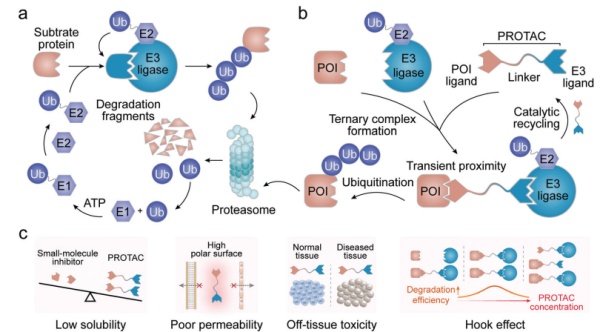
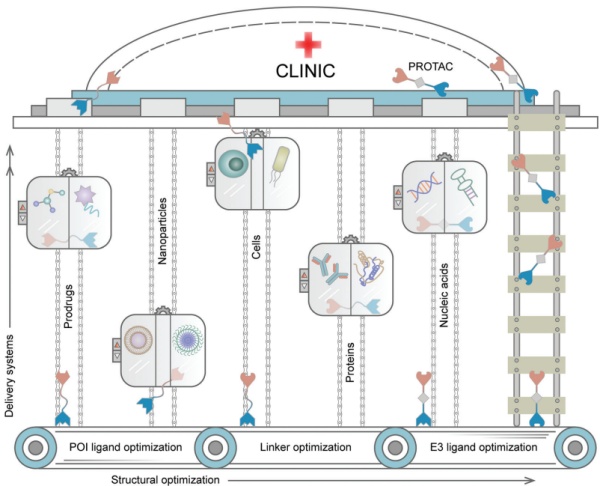
PROTAC自2001年首次报导成为一种新型治疗方式,通过劫持泛素蛋白酶体系统(UPS)来降解靶蛋白。从最初的基于嵌合肽的化合物结构演变为可渗透细胞的小分子,PROTAC的研究热度不断增长并显示出显著的临床转化潜力。继2019年首批进入临床试验的两种抗癌PROTACs问世后,其他几种小分子降解剂也相继进入临床试验用以治疗各种疾病(表1)。然而,尽管在临床前研究中表现出较好的治疗前景,但大多数PROTAC难以进入人体临床试验阶段。PROTAC能重新引导UPS识别和降解与各种疾病相关的蛋白质(POI)。其一般分为两步:(1)通过共价结合将泛素分子标记到靶蛋白上;(2)蛋白酶体降解多聚泛素化的蛋白。针对POI和E3连接酶的两个不同配体组成的PROTACs由短linker桥接,能在分子水平上控制细胞内生物过程和POI相关细胞功能。与RNA干扰(RNAi)和CRISPR-Cas9等基于核酸的蛋白质调控技术不同,这些低免疫原性嵌合体可引发快速的POI降解,对基因组和转录组的影响可忽略不计,具有更多潜在的药物特性。但PROTAC自身的缺点限制了其临床实用性。首先,分子量较大(超过800Da)的PROTAC在水中溶解度差,导致其生物利用度低。其次,PROTAC的高极性表面限制了它们的渗透性并阻碍了它们穿过生理屏障和细胞膜的能力。第三,由于E3连接酶广泛表达于疾病部位和正常组织内,这很可能导致PROTAC产生脱靶等副作用。最后,具有较高细胞内浓度的PROTAC会倾向于形成二元复合物产生Hook效应,这会降低靶标降解活性并阻碍对其体内给药剂量的设计。溶解度差、渗透性差、生物利用度低、非特异性生物分布和不可预测的Hook效应阻碍了PROTACs的临床转化。图1. PROTAC介导的蛋白质降解机制示意图及局限性除了对PROTAC分子结构进行修饰以克服这些缺点外,药物递送系统也可以成为一种有效的替代策略,通过将PROTAC包装到递送载体中,将其快速输送到疾病部位。这些递送系统可以最大限度地减少与生物系统的非特异性相互作用,通过减少不需要的组织积累来减少副作用,并在患病部位时空可控释放PROTAC以实现其功能。包入或结合到递送载体的PROTAC受益于载体本身的高负载能力、长循环半衰期、靶向能力和刺激响应释放特性,可以规避其自身的高疏水性,提高生物利用度和促进选择性积累。因此,为PROTAC设计的递送系统很可能成为这些嵌合分子的未来临床转化起到重要推动力。在本文中,我们将详细介绍基于PROTAC当前递送系统的最新进展,概述面向PROTAC递送系统的设计原则(图2)。此外,除了讨论当前PROTAC输送系统的优缺点,我们还将介绍PROTAC在与递送系统结合后的临床应用。图2. 针对PROTAC的递送系统和结构优化以使其推向临床转化
过去二十年以来,越来越多科学家开始针对各种理化性质较差的药物开发其新型药物递送系统,以提高其溶解度、细胞内积聚、位点特异性分布并最大限度地减少副作用。得益于其负载能力、更长的循环周期和靶向能力,药物递送系统可帮助PROTAC规避疏水性、提高生物利用度并大幅提高其成药性。本节将主要介绍并归类各种已被报导的PROTAC递送系统。魏课题组发现,通过向降解剂引入一些可去除基团,以化学修饰的方法来克服其本身不利的药代动力学性能(图3a)。将亲脂性的新戊酰氧基甲基结合到靶向CDK2/4/6的PROTAC的酰亚胺基团中,以提高其口服生物利用度(图3b)。获得的PROTAC前药经过口服被吸收后,可以轻易转化为活性PROTAC并在体内介导CDK2/4/6的降解,成功抑制B16F10肿瘤生长。魏课题组在一项利用选择性小分子配体构建KEAP1泛素连接酶招募的PROTAC研究中,将E3连接酶KEAP1的羧酸酯化,成功得到了具备细胞渗透性PROTAC MS83(图3c)。与其非酯化的PROTAC相比,MS83在较低浓度下即可有效降解目标蛋白,但相应乙酯基团在细胞内水解以释放功能性羧酸所需的时间更长。
在另一项研究中,Fischer课题组引入了常用的可切割型新戊酰氧基甲基基团来屏蔽eIF4E靶向的PROTAC的羧酸基团(图3d),从而提高了其细胞吸收水平。这些研究结果表明,使用可切割型的亲脂性基团修饰,可以屏蔽掉一些官能团的强极性并相对地提高其疏水性和透膜能力。这是一种改善化合物细胞通透性和其他药代动力学特性的较为简便直接的策略。
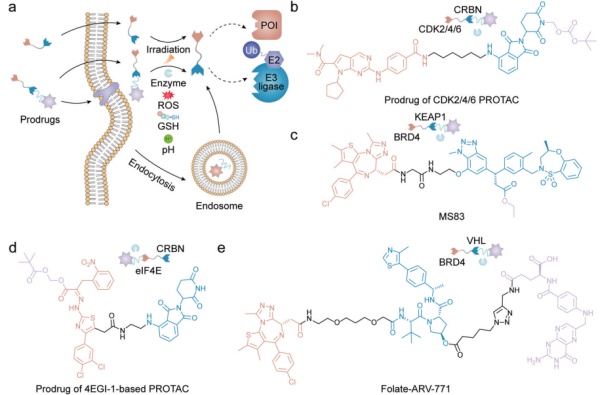
图3. PROTAC前药诱导的蛋白降解示意图
为了避免PROTAC在病灶组织外脱靶降解引起潜在毒性,Liu等人提供了一种基于PROTAC的靶向叶酸受体α(FOLR1)递送策略,以选择性降解具有高FOLR1表达的癌细胞中的POI,而不是非癌细胞中的POI(图3e)。三种叶酸封闭的PROTAC前药叶酸-ARV-771、叶酸-MS432和叶酸-MS99,分别以FOLR1依赖的方式在癌细胞内有效诱导BRD、MEK1/2和ALK融合蛋白的降解。而基于光控技术设计的前药则可用于解决降解剂所带来的脱靶或细胞毒性问题。最近有报导称这种技术可以时空可控地释放或激活PROTAC。PROTACs首先会被光牢笼基团覆盖以掩盖它们的活性,随后这些光笼基团通过特定刺激响应性的被切割释放出活性PROTACs(图3a)。薛等人将光响应型基团4,5-二甲氧基-2-硝基芐基(DMNB)引入BRD4靶向的PROTAC,从而开发出pc-PROTAC1(图4a)。通过DMNB与BRD4配体的酰胺氮相连以防止三元复合物的形成。一旦pc-PROTAC1暴露于紫外线(UV)光后,前药即被裂解释放出API并诱导活细胞中的BRD4降解。
此外,靶向BTK的光笼降解剂pc-PROTAC3也被设计出来,DMNB与CRBN配体的酰亚胺氮相连。pc-PROTAC3对BTK的降解与pc-PROTAC1一样受到紫外光照射的影响。刘课题组还通过开发靶向BRD4和ALK的PROTAC、Opto-dBET1和Opto-dALK的前药证明了这种光笼策略的可行性(图4a)。
此外,Kounde等人还报导了另一种靶向BRD4的光笼PROTAC,PROTAC 3(图4a),通过将DMNB基团引入VHL配体的羟基,同样经光照激发后产生活性PROTAC 3,其在BRD4表达的HeLa细胞中表现出显着降解。这些例子表明PROTACs也可以利用基于DMNB的前药策略,以克服与毒性相关的问题。Naro等人也报导了类似的发现,他们将光笼基团二乙氨基香豆素(DEACM)引入到降解剂的羟脯氨酸部分以阻碍其对泛素连接酶VHL的募集(图4a)。由此产生的ERRα靶向PROTAC-2经过光解产生天然ERRα PROTAC-1。被光牢笼屏蔽的PROTAC-2 在紫外线照射下成功降解了MCF-7细胞中的ERR蛋白,而在没有照射的情况下没有观察到明显的蛋白降解。
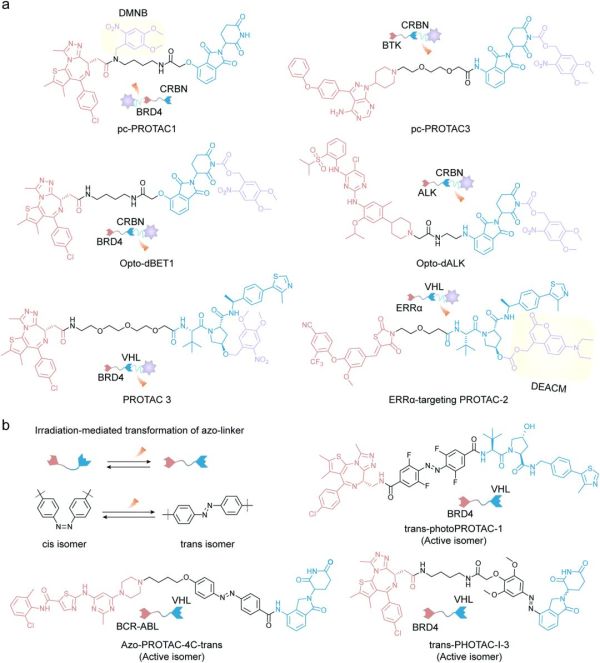
图4.(a)具有光笼基团的代表性PROTAC化学结构。(b)具有基于偶氮苯的光开关型PROTAC的化学结构
虽然光笼PROTAC可以时空可控地降解蛋白质,但它们的光依赖性激活无法中断并且是不可逆的。普法夫等人利用偶氮苯作为光开关开发了photoPROTAC-1(图4b),该策略可以实现可逆的光学控制。光电开关的设计是利用顺式和反式偶氮苯之间的长度差异。photoPROTAC-1在415 nm光下以95%的效率进行偶氮苯的顺式到反式的转化,而在530 nm光下以68%的效率进行反式到顺式的转化。因此,反式-photoPROTAC-1可以有效地降解Ramos细胞中的 BRD2,但如果photoPROTAC-1在用530 nm光照射后将不会引起明显的降解。该研究表明,基于光开关设计的photoPROTAC,其降解活性是可逆可调节的。金等人使用类似的策略通过将偶氮苯引入linker部分开发出针对BCR-ABL的偶氮-PROTAC(图4b)。具有反式构象的PROTAC-4c显示出BCR-ABL的显着降解,并且在光照射介导的顺势转化后同样不具备了蛋白质降解能力。此外,Reynders课题组通过将偶氮双键引入到泊马度胺的结构中以制备靶向BET的光控PROTAC,称为PHOTAC(图4b)。最有效的嵌合体PHOTAC-I-3可以在390 nm紫外光下转化为活性反式异构体,在500 nm光下转化为非活性反式异构体。并且他们探索出一种通过调整入射光来控制形成的活性物质浓度的方法,随着波长从390 nm增加到525 nm,BRD4水平逐渐升高。这一发现提供了一种新方法使其能通过滴定系统调节活性PROTAC的浓度来实现对体内hook效应的预测和控制。尽管PROTAC前药的报导数量迅速增加,但这些PROTAC前药的设计目标主要集中在提高其细胞渗透率和优化其可控释放来克服组织外脱靶毒性。由于缺乏足够的体内数据,这种前药PROTAC递送策略未能发挥其最大应用价值。此外,PROTAC前药策略也存在一些缺点。首先,通过化学方法来推动PROTAC达到释放灵敏度和结构稳定性的一个平衡点本身就需要大量的努力。此外,鉴于PROTAC本身庞大的结构,额外的结构修饰会进一步恶化其物理化学特性。由于其激发波长大多为波长较短的紫外线,这会使其组织穿透力较差从而使这些光控PROTAC仅适用于表面病灶部位。
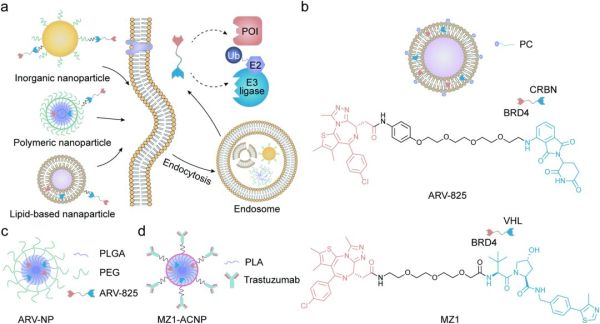
图5. (a)基于纳米粒子的PROTAC递送系统示意图
脂质体可由大量亚结构构成,是一种多功能载体。大多数基于脂质的纳米颗粒是球形囊泡,其脂质双分子层内往往包裹了一致多个水溶性组件。脂质体作为药物递送系统具有许多优点,例如配方简单、生物兼容性好、生物利用度高、负载能力优秀和灵活可调节的理化性质。Fu课题组开发了一种能同时携带蛋白激酶C抑制剂、棕榈酰-dl-氯化肉碱(PC)和靶向BRD4的PROTAC——ARV的脂质体(图5b)。该纳米粒被命名为LARPC。
由于PC具有亲脂性棕榈酰炼和亲水性肉碱头基,因此PC的棕榈酰炼和疏水性ARV均位于脂质双层内。LARPC的粒径为105.25 ± 2.76 nm,该脂质体可借助其高通透性和EPR效应选择性地在肿瘤组织部位聚集。26.6 mV的正表面电荷促进了其在肿瘤组织内的渗透并增强了其进入癌细胞的能力。LARPC表现出对黑色素瘤细胞系的有效抑制作用,其为使用脂质体PROTAC制剂治疗黑色素瘤提供了前景。脂质体通常由可形成单层和多层囊泡结构的磷脂组成。这些纳米颗粒由脂质双层和水腔组成,使它们既能够封装亲水又能搭载疏水药物分子。由于水溶性差,大多数PROTAC分子只能装载到磷脂双层而不是大的水性腔室,这使得脂质体在PROTAC上的应用潜力收到质疑。
然而,PROTACs可以用亲水基团进行化学修饰以改变其溶解度,这可以增加脂质纳米颗粒亲水核心中的PROTACs的装载量。脂质体疫苗COVID的获批让人们更加意识到PROTAC和脂质纳米颗粒的整合能促进PROTAC的临床转化。
聚合物纳米粒子具有多种结构和特性,它们由源自天然或人工合成的单体或聚合物制成的。由于其高生物兼容性、简单的制备过程和可调节的物化性质,聚合物纳米粒是优良的递送载体。这些纳米粒还可以搭载各种治疗药物,包括小分子和大分子。Saraswat课题组以聚合物PLGA-PEG为基础,通过纳米沉淀法制备可生物降解的纳米颗粒,用于递送靶BRD4向的PROTAC,ARV-825。在聚合物基质中保护ARV-825免遭代谢降解的纳米颗粒称为ARV-NP(图5c),合适的尺寸(<200 nm)使其能通过EPR效应被动靶向到实体瘤。富含PEG的表面有利于延长循环时间。基于体外表征结果,ARV-NP表现出良好的物理稳定性、可控的药物释放和可忽略的溶血性。
此外,ARV-NP在抑制MIA PaCa-2细胞的活性、迁移和克隆形成方面显示出强大的体外抗癌作用。在另一项研究中,Cimas等人将靶向BRD4的PROTAC MZ1掺入聚乳酸(PLA)纳米颗粒中,以提高其对实体瘤的疗效。为了进一步提高载有MZ1的纳米粒子对乳腺癌细胞的靶向能力,研究人员将曲妥珠单抗(一种对膜蛋白-人表皮生长因子受体2(HER2)具有特异性的抗体)结合到这些纳米粒子的表面,图 5d)。曲妥珠单抗结合介导的细胞摄取和改进的纳米颗粒介导的PROTAC可控释放,由此产生的MZ1-ACNPs相比于游离的MZ1对两种过表达HER2的乳腺癌细胞系表现出更强的细胞毒性。聚合物纳米粒子是一种高效的递送系统,可用于改善位点特异性PROTAC递送,尤其是在配备疾病靶向配体时。聚合物纳米粒子可以非常灵活地装载组搭,被递送药物可以装在粒子核心、与粒子表面结合、装在聚合物基质中或与聚合物结构产生化学连接。
此外,可以通过调节聚合物的组成、稳定性、环境刺激和表面电荷来精确控制这些纳米粒的负载功效和释放动力学。然而,聚合物纳米颗粒也存在一些缺点,例如更高的颗粒聚集风险和免疫原性相关毒性。因此,只有极少数的聚合物纳米粒被FDA批准用于临床。
由无机材料(包括金、铁和二氧化硅)合成的纳米粒可以用作多功能药物递送系统,因为它们能够形成各种尺寸、结构和几何形状。生物兼容且稳定的无机递送系统能够帮PROTAC克服其固有局限性。严课题组利用金-硫醇介导配位形成的金纳米颗粒-肽簇并将其用于PROTAC来降解癌MDMX蛋白。这种具有谷胱甘肽响应性的纳米簇促进了靶向MDMX的PROTAC的细胞内化和胞内释放。纳米簇表面配备有对pH敏感的聚丙烯酰基巯基咪唑(PSI),以进一步提高其肿瘤靶向效果。这些纳米颗粒还具有良好的安全性,并在患有原位视网膜母细胞瘤的小鼠模型上进行眼内注射或尾静脉注射后,其药物显示出有效的抗癌功效。除金纳米粒外,其他广泛研究的无机材料,如源自磁铁矿、磷酸钙和介孔二氧化硅的纳米粒,也常用于递送药代动力学较差的药物。过去几十年,基于纳米颗粒设计的递送系统的研究层出不穷。已批准的纳米药物(如Abraxane和Doxil)的临床结果表明,药物载体能成功地减少了药物本身的副作用,从而让需多次给药的化疗药物的毒性控制在一定范围内。尽管已经开发了许多先进的纳米粒递送系统以提高疗效,但只有一小部分纳米粒进入了临床试验。一些挑战阻碍了纳米粒输送系统的临床转化。首先,纳米材料的免疫原性可能会降低载药纳米粒带来的功效。第二,至少在临床前研究中,具有多种功能和进一步修饰的纳米载体可以显着提高治疗效果并克服免疫原性问题,但其复杂性同时为规模化制造和进一步转化带来了额外的障碍。最后,一些纳米粒子设计的基本原理,例如纳米粒子在肿瘤中积累的高渗透性和EPR效应,从动物肿瘤模型直接移植到临床实用上是不可靠的。但对PROTAC而言,纳米载体确实可以克服蛋白质降解剂的组织外靶向副作用。此外,鉴于独特的作用机制,PROTACs本身俱有克服耐药性的潜力。由于催化能力,配备递送系统的PROTAC将显着降低给药频率,降低载体相关毒性或免疫原性的风险。此外,COVID-19疫苗与脂质纳米颗粒的成功结合为PROTACs等理化性质较差但治疗效果优越的治疗药物带来了巨大希望。从另一个角度来看,纳米颗粒可以使给药途径多样化(从原来单一的口服到静脉注射等更多可选给药方式)并扩大PROTAC可治疗的适应症,从而扩大了它们的应用范围。总体而言,尽管存在诸多挑战,但基于纳米颗粒的PROTAC递送系统将成为PROTAC临床转化的强大动力。天然生物大分子由于其良好的生物兼容性已成为可应用于体内的递送系统。最常用的天然生物大分子是蛋白质,它具有特异的分子结构来封装和聚合药物(图6a)。基于蛋白质的递送系统可以将药物运输到特定地点,因为它们具有三级结构介导的受体-配体识别能力。因此,基于蛋白质的递送设计也可以应用于PROTAC。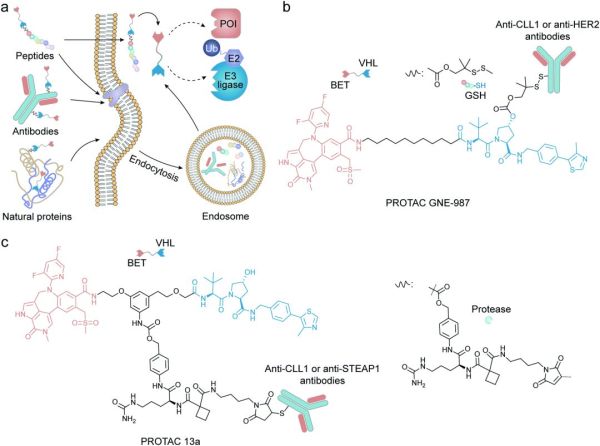
图6. 基于蛋白质的PROTAC递送系统诱导蛋白质的降解示意图
抗体被适应性免疫系统用于识别和中和病原体。抗体对其靶标具有高亲和力和特异性,之前已被用作药物递送载体的靶标配体。与其他基于蛋白质的药物递送方法相比,抗体-药物偶联物(ADC)更为普遍。ADC将抗体的靶向性和长循环特性与治疗药物相结合,最大限度地减少药物在正常组织中的积累来减少脱靶副作用。受ADC启发,Pillow等人开发了第一个抗体-PROTAC偶联物,将BET降解剂(GNE-987)连接到抗CLL1或抗HER2抗体,以克服其不利的物化性质和药代动力学特性(图6b)。使用含二硫键的linker通过在VHL配体内的脯氨酸位点的羟基上形成碳酸酯键得到衍生GEN-987。在将衍生物与抗CLL1抗体的胱氨酸连接后,PROTAC经静脉注射后其半衰期得到显着延长。在另一项研究中,Dragovich通过将PROTAC分子与靶向HER2的抗体结合,构建了由两种不同的雌激素受体α(ERα)靶向降解剂和三个独立的linker组成的复合物。两种靶向ERα的PROTAC均含有相同的ERα配体但不同的E3配体,当与抗HER2抗体结合时,它们都能有效地递送至其细胞内靶点。通过改变降解剂和抗体之间的linker结构和位置,作者证明了这些偶联物表现出良好的体内稳定性。最近Dragovich课题组系统地研究了抗体-PROTAC偶联物中的衍生位点、linker组分和响应特性对降解功效的影响。含有VHL配体的靶向BRD4的PROTAC被选为潜在靶头,进一步与STEAP1或CLL1抗体相连(图6c)。作者通过一系列实验证实抗体-PROTAC偶联物可以以抗原依赖性方式将PROTACs递送至靶细胞,从而产生有效的降解效果。总的来说,利用ADC技术扩展了PROTAC的应用,为其递送开辟了新方向。然而,在设计基于抗体的PROTAC递送系统时仍然存在一些挑战。与抗体部分相关的挑战包括(1)找到在靶细胞上高表达但在正常组织中低表达的理想抗原,以及(2)抗体与相关抗原是否能充分结合以及是否能有效内化。抗体-PROTAC linker相关的问题包括(1)是否具有良好的循环稳定性和(2)内化后PROTAC能否有效释放。在设计有效的抗体-PROTAC偶联物时,这些障碍进一步体现了抗体的选择和linker优化的重要性。虽然抗体-PROTAC偶联物具有许多优点,但这些分子体积庞大可能会导致免疫原性并且难以穿过生理屏障。相比之下,具有低分子量且免疫原性较小的肽可以作为这些抗体-PROTAC偶联物的理想替代品,因为它们可以执行与其较大的蛋白质对应物相似的功能。研究人员已开始设计和构建用于PROTAC递送的基于多肽的载体。Rodriguez-Gonzalez利用聚精氨酸的细胞穿透肽(CPP)来修饰针对AR和ER的PROTAC,分别用于乳腺癌和前列腺癌的治疗。同样,Montrose课题组使用聚精氨酸序列将靶向X蛋白的PROTAC转运至靶细胞。这些工作为其他研究小组引入聚精氨酸肽和其他膜穿透基序以改善PROTAC的细胞摄取铺平了道路。与庞大的蛋白结构相比,肽有几个优点,包括易于生产、储存和处理。然而,在开发基于肽的PROTAC递送系统方面仍然存在一些挑战。首先,肽容易发生水解,导致体内稳定性差和半衰期短.其次,与蛋白质相比,肽的简单结构降低了它们的靶向能力。最后,基于肽的递送系统可能会导致严重的毒性,因为这些基于肽的靶向部分,尤其是CPP,缺乏特异性。除了上述基于抗体和肽的药物递送系统外,许多天然蛋白质如白蛋白、铁蛋白和转铁蛋白也具有运输PROTAC分子的潜力。单个蛋白质分子具有疏水腔,可以封装或结合PROTAC。许多蛋白质可以通过人工方法或自聚集形成聚集体来包装PROTACs。此外,单体和聚集体也可以进行化学或生物修饰,以进一步增强其功能或药代动力学特性。这也有助于PROTAC的装载、递送、释放和协同功效。基于蛋白质或肽的PROTAC递送系统所引发的问题也不容忽视。例如蛋白质或肽诱导的毒性,例如血液毒性和免疫原性。而循环过程中蛋白质载体的降解也可能导致PROTAC过早释放,从而导致治疗效果的降低和脱靶副作用。尽管未修饰的核酸通常需要递送系统才能发挥其治疗作用,但针对脱氧核糖核酸(DNA)或核糖核酸(RNA)技术的最新进展揭示了核酸的新功能和理化/生化特性,这激发了人们将核酸作为递送系统的新方向。例如,利用碱基对的互补配对原则,选择适配体、剪接处理后的单链DNA或RNA分子用以结合特定的目标。与肽折叠成蛋白质的过程类似,核酸折叠迭成不同的二级结构,然后进一步修饰形成能识别其靶目标的独特的三维结构。例如,适配体由于高亲和力和特异性,可以将药物引导至所需的细胞或组织(图7a)。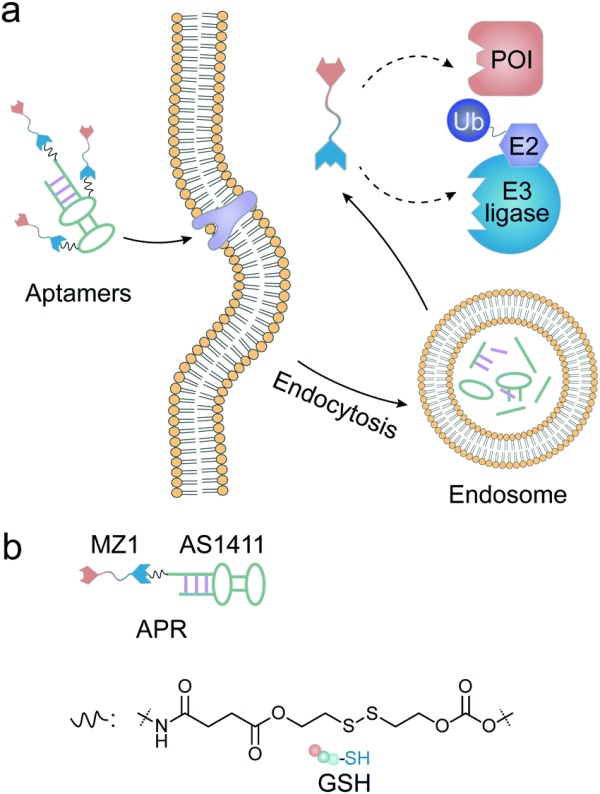
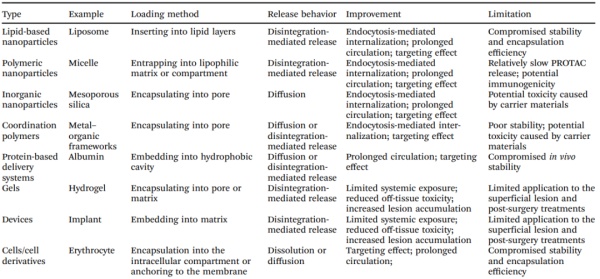
图7.适配体-PROTAC偶联物介导的蛋白质降解示意图He利用名为APR的酯-二硫键linker将靶向BET的PROTAC—MZ1连接到核酸适配体AS1411(图7b)。体外结果表明,AS1411能选择性识别并结合过表达核仁素的癌细胞,引发胞吞介导的内化作用。随后,递送系统在细胞内受谷胱甘肽响应引发二硫键断裂释放出降解剂。得益于高效的内化和释放作用,APR在核仁素过表达的癌细胞中展示对了BRD4的高降解效率。该研究证实,PROTACs与适配体的结合能高效促进PROTACs的递送,包括增加细胞内化、提高靶向性降低脱靶副作用和增强体内降解效力。基于核酸的PROTAC递送系统,其发展仍处于起步阶段,其仍面临一些问题。核酸PROTAC递送系统由于其在体循环中的不稳定性会被快速代谢清除,大大降低了递送系统的半衰期。此外,免疫系统可以识别这些核酸并可能诱导过度的免疫反应。核酸递送载体也可能会受到聚阴离子效应的影响导致潜在的毒副作用。不同的给药系统在PROTAC的装载方式、释放行为和给药途径方面存在许多差异,根据PROTAC与给药载体之间的组装方法,可以将PROTAC制剂归为两种不同类型,包括PROTAC导向的递药系统和受PROTAC理念启发的递送系统。对于PROTAC为核心的递送系统,PROTAC分子是具有高效力的疏水性药物,但物化学性质较差。这些递送系统的目标是增加溶解度、增强细胞内化、促进病灶部位积累和减少副作用。根据PROTAC与递送系统之间的相互作用,这类制剂又可分为两类:PROTAC物理包封递送系统和PROTAC化学偶联递送系统。本节将详细介绍可以克服PROTAC主要缺点的递送系统,总结它们的选择规则、搭载方法、释放行为、优势和限制。有几种递送系统可以用共价或非共价配体、烷基或PEG linker物理封装PROTAC。这些递送系统能够有效地装载小的疏水化合物并将它们递送到目标位置。除了之前讨论过的脂质纳米粒、聚合物纳米粒和基于蛋白质的递送系统外,介孔二氧化硅、金属有机框架和水凝胶也具有递送PROTAC的潜力。这些载体材料可用作治疗剂或赋形剂,其安全性和有效性已通过临床试验证明。如表2所列,在不同的递送系统中,PROTACs主要被包裹在亲脂性基质、隔室或腔中。它们也由载体材料的单体或聚集体通过疏水、静电、氢键相互作用、范德华力和π-π堆积力。一旦递送过程完成,降解剂会随着载体材料的解离而发生溶解、扩散或释放。鉴于这些先进剂型的调整相对容易,将特定的敏感基团加入载体中可能会形成响应性释放PROTAC。总体而言,鉴于低毒性、可生物降解性和高递送效率,这些PROTAC递送系统是帮助蛋白降解剂实现临床转化的一个方向。表2. 用物理方法搭载PROTAC的已发布和潜在的递送系统
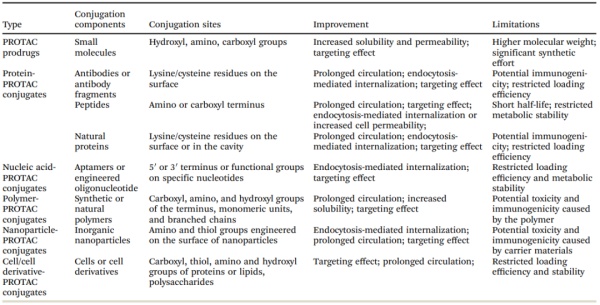
与物理封装不同,化学连接仅适用于具有可修饰基团的PROTAC,例如胺、羧基和羟基。从理论上讲,这些PROTAC可以与各种载体或生物材料结合,从小分子、抗体、肽、适配体、聚合物、纳米粒。此外,化学连接构建的PROTAC递送系统的一个重要组件就是连接着PROTAC和载体分子的linker。linker必须在运输过程中保持较好的稳定性,但也必须是可降解的,以便在内化到亚细胞器时允许PROTAC有效释放。
因此,很多载体的linker被设计成能响应特定酶或环境变化进而引发水解反应。有的也被设计成对诸如超声波、磁力和辐射的外源信号或内源刺激(包括酸性环境、氧化还原应激或缺氧条件)敏感。一旦PROTAC与载体或基团结合,它们的理化性质包括活性通常会发生变化,这使得PROTAC能够克服细胞通透性低、药代动力学特征差、生物分布不良和副反应等缺陷。然而,PROTAC的化学偶联递送策略也一些限制(表3)。表3. 已发表的和潜在的借助化学连接构建的PROTAC递送系统
通过利用亲电试剂和亲核试剂之间的相互作用,具有可逆共价键的PROTAC也可以在无linker的情况下连接到递送系统中。例如,许多作为载体的生物蛋白质及合成生物材料,都具有游离硫醇,可以作为软亲核试剂与氰基丙烯酰胺等软亲电试剂反应。因此,具有可逆共价基序的PROTACs可以与载体分子形成共价键,从而在酸性微环境中运输和释放PROTAC。总的来说,对于那些是E3连接酶或靶蛋白的可逆共价配体的PROTAC,研究人员或许能够利用含亲核试剂的生物材料作为运载工具。PROTACs的基本作用机制是双功能嵌合体介导的E3连接酶和POI之间的相互作用,拉近E3连接酶和靶蛋白空间距离,引发蛋白酶体系统降解靶蛋白。实际上,除小分子外,许多递送系统成分,如肽、核苷酸、蛋白质片段、聚合物甚至纳米粒,也可以捕获或结合某些蛋白质以及E3连接酶。不仅如此,递送系统的空间结构可以为E3连接酶和POI的接近提供平台。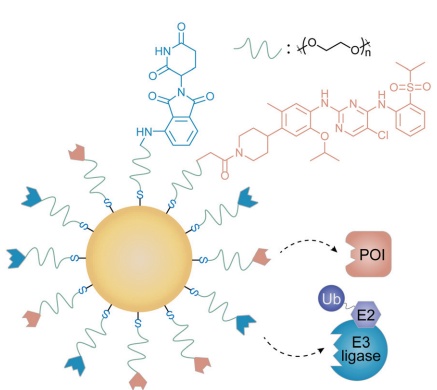
图8. 以金为基础设计的降解剂纳米粒Cer/Pom-PEG@GNP王课题组将CRBN和间变性淋巴瘤激酶(ALK)的配体结合到金纳米颗粒中,获得了一种受PROTAC启发的纳米颗粒,用以克服小分子抑制剂的潜在耐药性和脱靶效应。他们利用硫和金之间的相互作用,将硫醇修饰的柔性PEG用作填充物,将粘合剂连接到金纳米颗粒上。由此产生的基于金纳米颗粒的PROTAC,称为Cer/Pom-PEG@GNP,包含与ALK结合的ceritinib和E3连接酶配体pomalidomide(图8)。由于Cer/Pom-PEG@GNPs具有理想的尺寸和正表面电位,它们可以被NCI-H2228细胞有效内化。
此外,金纳米粒表面的偶联物在不同的生理模拟条件下都表现出良好的稳定性。在与NCI-H2228细胞共孵育后,Cer/Pom-PEG@GNP显示出有效的ALK降解效力并产生特定的细胞毒性。与纯粹的化学分子PROTAC相比,这种金纳米粒靶蛋白降解剂表现出理想的溶解度、稳定性和半衰期。总之,PROTACs和药物递送系统的融合让两者得以优势互补,受PROTAC机制启发的新型药物递送的设计也扩宽了递送系统的研究边疆。
以实体瘤为例,这些疾病由于其复杂的肿瘤微环境、耐药机制和异质性通常会给基于PROTAC的治疗带来各种挑战。PROTACs和其他常规疗法的结合能获得同步递送、协同治疗和可控释放等优势,这也将成为治疗这些复杂疾病的新兴趋势。张课题组借助组织蛋白酶B可切割肽将PROTAC片段与合成的半导体聚合物纳米颗粒聚合在一块。获得的纳米PROTAC被命名为SPN pro,其能将光疗和蛋白的可控降解结合在一起用于光免疫代谢癌症治疗。IDO靶向PROTAC肽包含广泛使用的IDO抑制剂NLG919、琥珀酸linker和VHL结合肽,旨在重新改造免疫抑制微环境。具有良好生物兼容性和可调光学特性的聚乙二醇半导体聚合物则被用作光疗组件。鉴于PEG片段尺寸更小,亲水性更强,SPN pro在体内的循环时间得以延长并能在原发肿瘤组织中逐渐积累。在被癌细胞内化后,SPN pro被组织蛋白酶B激活并快速释放出PROTAC,以VHL参与的蛋白酶体途径高效地降低了细胞内IDO的表达水平(图9)。在4T1荷瘤小鼠中给予纳米粒24小时后,在原发性肿瘤病灶部位使用近红外光(NIR)照射触发其免疫原性光疗,其与靶向IDO的PROTAC发挥协同作用以增强T细胞抗肿瘤免疫(图9)。此外,张课题组还使用类似聚合物纳米粒来递送靶向环氧合酶1/2(COX1/2)的PROTAC,以调控免疫抑制性肿瘤微环境并促进肿瘤免疫治疗。这些研究突出了由纳米粒介导的光疗法、免疫疗法和PROTAC整合的独特优势。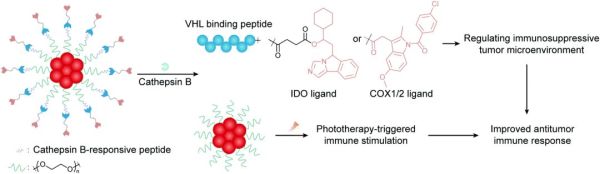
图9. 由聚合纳米颗粒介导的PROTACs、光疗法和免疫疗法的联合治疗示意图抗体-PROTAC聚合物可以同时实现POI降解和抗体介导的肿瘤特异性膜蛋白抑制的联合疗法。例如,靶向BRD4的PROTAC与曲妥珠单抗结合可以同时阻断HER2并降解BRD4。此外,装载PROTAC的水凝胶递送系统,例如将GT20029配制成凝胶(表1),可以实现局部给药与手术相结合的双重疗法。PROTACs通常被认为在治疗神经退行性疾病、心血管疾病、自身免疫性疾病和恶性肿瘤方面非常有前途。然而,鉴于其在体内快速的血液清除率和其他不利的药代动力学参数,实际给药时PROTAC难以在疾病部位达到足够的浓度,这会导致给药频率的增加和不良反应。具有延长循环时间或控释机制的靶向给药系统可以减少所需的PROTAC剂量,提高了需长期用药患者的依从性。
例如,罗课题组最近设计了一种HMGCR靶向的PROTAC以用于治疗高胆固醇血症(图10)。其通过将原PROTAC设计成内酯前药以提高其生物利用度。改造后的PROTAC前药经口服后能极大改善PROTAC的血浆暴露量,并显着降低了患有动脉粥样硬化的小鼠胆固醇含量。这一发现表明,合适的递送系统或制剂可以让PROTACs在被口服后仍然保持较高的生物利用度。除了改善其不利的药代动力学特性外,在引入响应释放机制后,递送系统还可以通过延长PROTAC的活性时间来降低给药频率。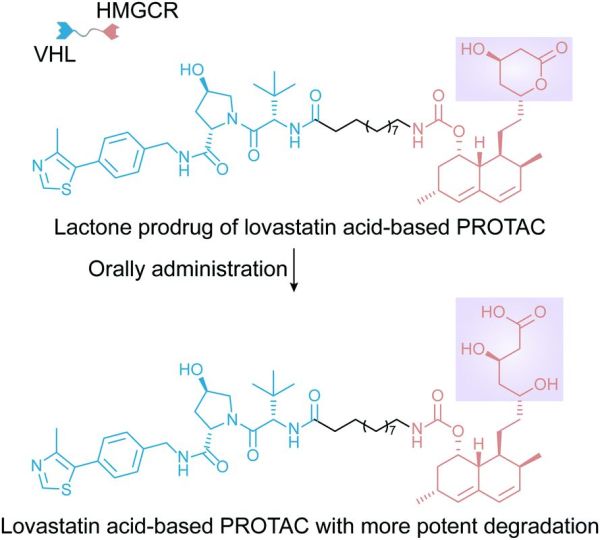
图10.靶向HMGCR的PROTAC的化学结构
针对PROTAC递送系统的开发能加快其从实验到临床的转化步伐。这些递送系统能够优化PROTAC的理化性质、实现靶向递送、促进细胞内积累和提高其降解效力。得益于递送系统的卓越负载能力,PROTAC也可以与其他疗法实现共同递送,达到联合治疗的目标。此外,通过引入刺激响应机制,PROTACs能够在特定时空条件下从递送系统中持续释放出来,此策略可解决Hook效应引起的剂量不可预测性。而通过与材料科学、化学和生物工程等多个跨学科领域的先进技术相结合,PROTACs的递送系统可得到进一步优化扩展,并将其定制为精准医学以满足每种疾病的治疗需求。但PROTAC的递送仍然存在一些挑战。首先,额外的载体材料和药用辅料可能会增加与PROTAC相关的制造成本。其次,PROTAC和相应的药物递送系统的安全性必须得到严格保障,在发挥其优化效果的同时确保其副作用在可接受范围内。现如今,COVID疫苗脂质体的安全性和有效性得到证实和认可,这对于PROTAC递送系统的开发是一个鼓舞人心的消息。同时,PROTAC递送系统的设计也将使其他一系列具有蛋白质降解能力的嵌合体受益。例如LYTAC(靶向溶酶体的嵌合体)和AUTAC(靶向自噬体的嵌合体)/ATTEC(自噬体衔接化合物)。因此,针对PROTAC递送系统的探索和评估对整个蛋白降解剂领域的发展起到了承前启后的作用。来源:同写意
















{replyUser1} 回复 {replyUser2}:{content}