二代PROTACs:如何实现肿瘤特异性靶向
PROTACs已被用于降解感兴趣的蛋白靶标。与小分子抑制剂相比,PROTAC可以降解细胞内的任何蛋白质,包括不可成药的靶点,如转录因子和支架蛋白。尽管前景看好,但传统的PROTAC通常表现出不利的药代动力学,并且缺乏肿瘤特异性,这可能会由于它们在正常组织中的非特异性分布而导致全身毒性。因此,实现肿瘤特异性递送并增强PROTAC的抗肿瘤效力仍然是一个巨大的挑战.
为了实现PROTAC的肿瘤靶向递送,目前已经有几种策略被开发出来,例如抗体-PROTAC、叶酸-PROTAC和Aptamer-PROTAC结合物以及Poly-PROTAC纳米颗粒。这些修饰的PROTAC显示出更好的肿瘤蓄积和抗肿瘤效力。本文就目前增强PROTAC肿瘤特异性靶向的策略做一个简单介绍。
抗体-PROTAC (DAC)
建立在带有细胞毒性有效载荷的ADC不断取得的临床和商业成功基础之上,为了改善其DMPK特性,使PROTAC降解剂在体内能够更加有效的递送,不少研究探索了将PROTAC降解剂与单克隆抗体偶联。抗体与PROTAC降解剂所产生的新的分子被称为“降解剂-抗体结合物”(DAC),它相对于PROTAC分子具有几个潜在的优势:(1)可以在体内递送具有较差物化性质或DMPK特性的降解剂;(2)避免了复杂的配方,这些配方通常是使PROTAC在体内暴露中获得活性所必需的;(3)将感兴趣的PROTAC分子靶向特定的肿瘤或组织。
最早发表在同行评审的文献中的DAC的例子之一出现在2020年初,其描述了高效力的、基于VHL连接的针对溴结构域蛋白4(BRD4)的降解剂 (GNE-987)通过新的含二硫键的可切割连接子连接到靶向CLL1抗体上(图1)。
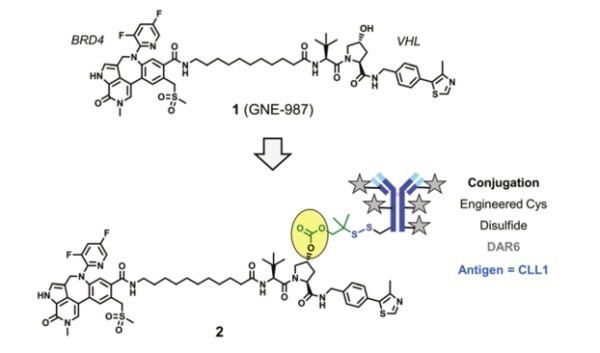
图1. BRD4-靶向DAC,二硫键连接子该DAC在单次静脉给药的HL-60和EOL-1急性髓系白血病(AML)异种移植模型中,显示出强大的、剂量依赖的体内抗肿瘤效应。并且对照实验显示:(1)没有偶联降解剂的CLL1抗体没有体内活性;(2)携带GNE-987羟脯氨酸同分异构体有效载荷的DAC同样无效;(3)识别HER2抗原的相应的DAC (在AML细胞上不高表达)在相同剂量下体内活性较弱;(4)未偶联的GNE-987是无活性的,其较差的PK特性可能是造成这种结果的原因。总之这些结果提供了一个概念验证,即DAC 可以通过连接酶依赖性降解机制并以抗原依赖性的方式在体内发挥抗肿瘤作用,而且DAC可以克服PROTAC 不良PK特性,并实现可接受的 PROTAC 溶酶体稳定性。
目前还有许多其他报道的针对其他靶点的DAC用于肿瘤靶向(图2),这里不再一一详述。
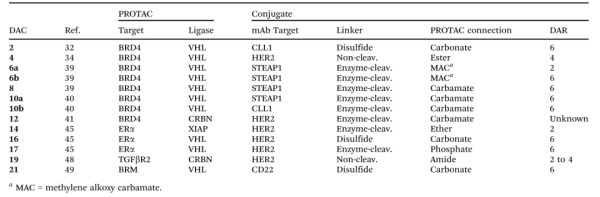
图2.用于肿瘤靶向的DAC分子
叶酸-PROTAC
叶酸受体α(FOLR1)是向癌细胞输送药物的最明确的靶点,因为FOLR1在许多癌症类型中高表达,如卵巢癌、肺癌和乳腺癌,而正常组织或细胞的FOLR1表达很低或不表达。除了FOLR1,其他受体,如FOLR2和FOLR3,也能将叶酸输送到细胞,而它们对叶酸的亲和力相对低于FOLR1。因此,FOLR1靶向策略已经在肿瘤成像和癌症靶向药物输送中大量研究与应用,几种FOLR1靶向药物也已处于II/III期临床试验。
这促使研究人员开发了使用叶酸结合策略将PROTACs特定地输送到癌细胞中,以实现目标蛋白的可控靶向降解,从而消除对正常组织的潜在有害毒性。为此,有些研究设计了叶酸-PROTAC,它优先转运到高表达FOLR1的癌细胞中。进入癌细胞后,叶酸-PROTAC在细胞内水解酶的催化下释放叶酸部分,然后PROTAC招募内源性VHL E3泛素连接酶泛化POI,供26S蛋白酶体随后降解(图3)。
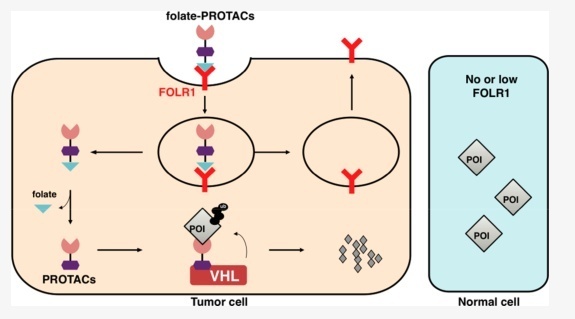
图3. 叶酸-PROTAC机制示意图
在JACS期刊上发表的题为“Cancer Selective Target Degradation by Folate-Caged PROTACs”研究证实叶酸PROTAC,包括BRD PROTAC(叶酸-ARV-771),MEK PROTAC(叶酸-MS432)和ALK PROTAC(叶酸-MS99),能够在癌细胞中以叶酸受体依赖的方式分别降解BRD,MEK和ALK。这一设计为PROTAC实现癌细胞中POI的选择性降解提供了一个可推广的平台。
Aptamer-PROTAC (APC)
Aptamer是单链核酸,具有复杂的三维结构,如茎、环、发夹和G4聚合物。它们通过氢键、范德华力、碱基堆积力和静电效应与目标蛋白结合,具有高特异性和亲和力。Aptamer也称为化学抗体,与其他靶向载体相比具有显著的优势。Aptamer适合大规模制备,因为它们可以通过DNA固相自动合成;结构易于修饰,便于高效、可控地形成多种药物结构,并改善其水溶性;Aptamer表现出良好的组织渗透性和体内安全性,而没有明显的免疫原性。
近年来,Aptamer被广泛应用于针对人类肿瘤的靶向治疗。核酸Aptamer AS1411(AS)富含鸟嘌呤碱基,能特异性识别并结合nucleolin,nucleolin在肿瘤细胞膜上高度表达,被广泛用作肿瘤靶向治疗的生物标志物。AS本身对nucleolin过表达的肿瘤具有良好的抑制活性,目前正在进行II期临床试验。此外,AS 被广泛用作小分子药物靶向肿瘤递送的转运剂。
受到Aptamer在靶向癌症治疗中的前景的启发,研究人员开发了将Aptamer与传统的PROTAC相结合从而改善原始PROTAC的肿瘤靶向特性和抗肿瘤效力。题为“Aptamer-PROTAC Conjugates (APCs) for Tumor-specific Targeting in Breast Cancer”的研究,通过用AS Aptamer和一个可切割的连接子对BET PROTAC进行修饰,设计了第一个Aptamer -PROTAC结合物 (APC)(图4)。该APC对nucleolin高表达的MCF-7乳腺癌细胞显示出良好的特异性和有效的BET降解作用。因此,APC策略可能提供一个有价值的工具,通过改善传统PROTAC的水溶性、肿瘤靶向能力、抗肿瘤效果以及减少对正常器官的副作用来克服其缺点。
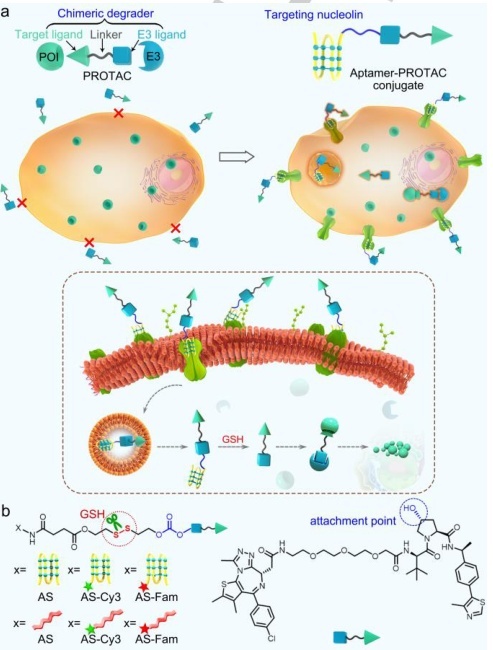
图4. AS-PROTAC结合物设计示意图
Poly-PROTAC纳米颗粒
近日在Nature Communications期刊上发表了“Engineered bioorthogonal POLY-PROTAC nanoparticles for tumour-specific protein degradation and precise cancer therapy”的研究,该研究设计了一种肿瘤微环境可激活的Poly-PROTAC纳米平台,用于实现PROTAC肿瘤特异性的抗肿瘤性能。
为了概念验证,该研究设计了用于肿瘤靶向BRD4的Poly-PROTAC纳米颗粒(图5)。首先合成了四种基于VHL的小分子Poly-PROTAC,然后设计了一系列可还原活化的多聚PROTAC,并自组装成胶束纳米粒用于系统的PROTAC递送。随后,设计了一种负载二苯并环辛炔(DBCO)的前靶向纳米颗粒,通过原位点击反应来增强叠氮修饰的Poly-PROTAC纳米颗粒在肿瘤内的蓄积。在内化到肿瘤细胞后,Poly-PROTAC纳米颗粒通过谷胱甘肽(GSH)介导的二硫键还原释放PROTAC有效载荷。研究发现,在MDAMB-231乳腺癌小鼠模型中,当Poly-PROTAC纳米颗粒与光动力疗法(PDT)相结合时,可以协同诱导肿瘤细胞凋亡。因此这项研究提供了一种用于肿瘤特异性PROTAC递送和增强癌症疗效的通用纳米平台。
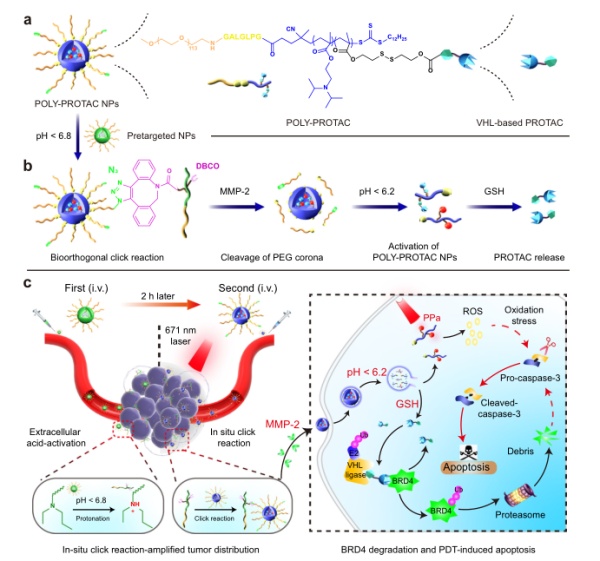
图5. Poly-PROTAC纳米颗粒结构以及MOA示意图
小编小结
准确地将PROTAC输送到肿瘤和有效地在肿瘤细胞内降解POI仍然是一个艰巨的挑战。因此,非常需要开发新型的PROTAC,用于肿瘤特异性POI的降解,同时将靶标上、肿瘤外的不良反应降至最低。目前大量的研究已经开发了二代PROTAC,以实现更多的肿瘤积累、更深的肿瘤穿透和更强的POI降解性能。尽管都还在临床前阶段,但我们有理由期待这些策略可以尽快的转换到临床益处,从而更好的帮助患者。
来源:清风 生物制药小编


{replyUser1} 回复 {replyUser2}:{content}