一周盘点 | 总缓解率高达96%的CAR-T细胞疗法、长效抑制乙肝病毒的RNAi疗法…
总缓解率高达96%的CAR-T细胞疗法、长效抑制乙肝病毒的RNAi疗法…
·
·
·
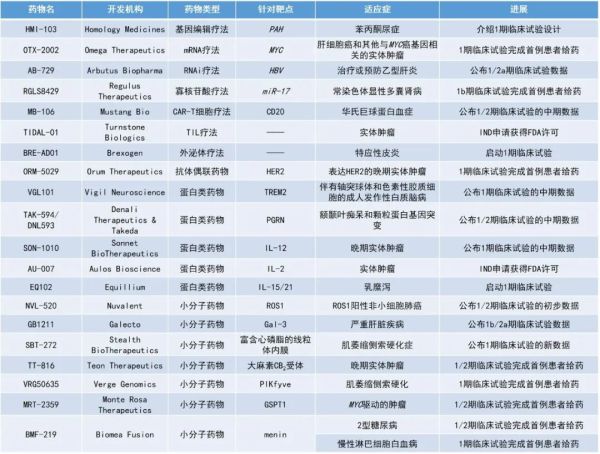
1. 治疗乙肝病毒感染的RNAi疗法AB-729公布早期临床数据,停药44周仍未发现临床复发迹象。2. 靶向CD20的自体CAR-T细胞疗法MB-106,在针对各种血液系统恶性肿瘤的1/2期临床试验中,观察到总缓解率(ORR)高达96%,完全缓解率(CR)高达75%。3. 潜在“best-in-class”ROS1选择性抑制剂NVL-520的1/2期临床试验结果公布,近半数ROS1阳性非小细胞肺癌耐药患者获得缓解。4. 针对肝细胞癌,靶向MYC的创新mRNA疗法OTX-2002完成首例患者给药。Arbutus Biopharma公司公布了其RNAi疗法AB-729在1/2a期临床试验中的数据。AB-729是一种靶向肝细胞的RNAi药物,它采用了Arbutus公司开发的新型共价偶联N-乙酰半乳糖胺(GalNAc)递送技术,能够皮下注射。在临床前模型中,AB-729可以抑制HBV病毒复制,减少所有病毒RNA转录副本,并降低所有HBV抗原,包括乙型肝炎表面抗原(HBsAg),在所有HBV基因型中显示出泛基因型活性。此次公布的1期试验结果显示,停止AB-729和核苷(酸)类似物(NA)治疗后长达44周内患者,没有临床复发的迹象,HBsAg和HBV的DNA依旧保持着低水平。联合给药的2a期试验中,与仅使用AB-729+NA治疗相比,再多添加第一代HBV核心抑制剂vebicorvir(VBR)不会对HBV感染标志物有更大的治疗改善,但也不会对HBsAg的减少产生负面影响。在该2a期试验中,所有方案总体上都是安全且耐受性良好的。Mustang Bio公司公布了其靶向CD20的自体CAR-T细胞疗法MB-106在1/2期临床试验中,华氏巨球蛋白血症(WM)队列中的中期数据。WM也称为淋巴浆细胞性淋巴瘤,是一种罕见的非霍奇金淋巴瘤(NHL)。CD20是一种在B细胞分化为浆细胞中起调节作用的跨膜蛋白。此次公布的数据显示,在包括滤泡性淋巴瘤、慢性淋巴细胞白血病、弥漫性大B细胞淋巴瘤在内的各种血液系统恶性肿瘤患者中,观察到的ORR为96%,CR为75%。其中,两名WM患者均获得了CR。获得CR的患者中,维持时间最长的为33个月。此外,所有既往接受过靶向CD-19的CAR-T细胞治疗的患者均对MB-106有反应。MB-106作为门诊治疗的安全性良好,没有出现3级以上的细胞因子释放综合征(CRS)或免疫效应细胞相关神经毒性综合症(ICANS)。Nuvalent公司公布了其在研ROS1抑制剂NVL-520于临床1/2期试验中剂量爬坡部分的初期结果。NVL-520是一种创新、选择性、具脑渗透性的ROS1抑制剂,设计用以治疗那些对现有ROS1抑制剂具抗性的癌症,例如那些带有G2032R、S1986Y/F、L2026M或D2033N突变的肿瘤。由于NVL-520具脑渗透性,因此具潜力改善那些肿瘤转移至脑部患者的治疗。这次所公布的ARROS-1临床1/2期试验是NVL-520的“first-in-human”研究,招募带有ROS1阳性的NSCLC与其他实体瘤患者入组,这些患者之前曾接受过前期治疗。在所有可检视疗效的病患中,有48%(10/21)达成部分缓解(PR),有76%(16/21)仍于试验中持续接受治疗。100%(3/3)具有可测量(>10mm)中枢神经系统转移的病患达成颅内部分缓解。此外,在所有35位入组的病患中,NVL-520展现出良好的安全性。OTX-2002是一款在研、潜在“first-in-class”用于治疗肝细胞癌的表观基因组学调节物。据估计,在多达70%的肝细胞癌患者中,MYC的过度表达与肝细胞癌的侵袭性有关。此药物能够通过脂质纳米颗粒(LNP)递送mRNA疗法,可在MYC基因转录以前,通过调节表观基因组来降低MYC的表达。Omega此前公布的临床前数据,支持了OTX-2002在多种体外和体内模型中的作用机制和抗肿瘤活性。多项体外研究表明,OTX-2002具有调节MYC表观基因组学谱并控制其转录前表达的能力。而OTX-2002单药或与标准疗法组合,在多种体内HCC模型中均能诱导强大的抗肿瘤活性。此外,使用OTX-2002治疗非人灵长类动物时,成功诱导了其肝细胞MYC转录前的下调。这些积累的临床前数据支持了OTX-2002为肝癌患者提供新的治疗策略的临床潜力。HMI-103是一种一次性体内基因编辑候选药物,用于治疗苯丙酮尿症(PKU)。PKU是一种由PAH基因突变引起的罕见先天性代谢错误疾病,若不及时治疗,苯丙氨酸在血液中的积聚将会导致进行性和严重的神经损伤。目前,尚无针对该疾病潜在遗传原因的治疗选择。HMI-103旨在利用人体同源重组的自然DNA修复过程,把具功能的PAH基因和肝脏特异性启动子整合到基因组,以最大限度地提高该基因的长期表达。TIDAL-01是一种下一代肿瘤浸润淋巴细胞(TIL)疗法,通过鉴定、选择和扩增患者特异性肿瘤反应性T细胞的最有效亚群,TIDAL-01旨在改善和扩大TIL的临床疗效,并克服当前基于TIL的疗法的局限性。目前,TIDAL-01正在两项1期临床试验中进行评估,一项针对乳腺癌和结直肠癌,另一项针对皮肤和非皮肤黑色素瘤。ORM-5029是一种潜在“first-in-class”抗体偶联药物(ADC)候选药物,旨在通过抗体选择性地将催化GSPT1蛋白降解剂递送给表达HER2的肿瘤细胞,使癌细胞死亡。临床前研究显示,与小分子GSPT1降解剂或标准护理的ADC相比,ORM-5029在低HER2环境中仍具有强大的体外和体内效力,并且作用具有剂量依赖性。Vigil Neuroscience公布了靶向髓样细胞触发受体2(TREM2)的激活性全人源单克隆抗体VGL101,在健康受试者中的1期临床试验的积极中期数据。TREM2是小胶质细胞表达的一种重要受体,在小胶质细胞对中枢神经系统(CNS)的损伤应答中发挥作用,是治疗神经退行性疾病的一个具有潜力的分子靶点。VGL101的首个适应症将是伴有轴突球体和色素性胶质细胞的成人发作性白质脑病(ALSP)。这是一种罕见的遗传性神经退行性疾病,由CSF1R基因突变引起。小胶质细胞功能障碍被认为是ALSP发病机制的核心,Vigil公司认为激活TREM2可以恢复小胶质细胞功能,从而为该疾病患者提供治疗益处。研究结果显示,VGL101具有良好的安全性、耐受性、药代动力学(PK)特征和脑渗透性。VGL101重复给药能使脑脊液中的sTREM2水平呈剂量依赖性的持续降低,sCSF1R水平持续升高,在给药三次或末次给药28天后仍能观察到sTREM2水平的降低。Vigil有望在本季度启动针对ALSP患者的2期试验。TAK-594/DNL593:公布1/2期临床试验的中期数据Denali Therapeutics公司公布了其前颗粒蛋白(PGRN)替代疗法TAK-594/DNL593在1/2期临床试验A部分的中期结果。TAK-594/DNL593一种研究性静脉注射、脑渗透疗法,采用Denali的蛋白质运输载体(PTV)技术,用于治疗额颞叶痴呆(FTD)和颗粒蛋白(GRN)基因突变患者。FTD是60岁以下人群中最常见的痴呆形式。编码PGRN蛋白的GRN基因突变通常会导致PGRN水平降低,并且是FTD最常见的遗传原因之一。目前尚无获批的药物来阻止或减缓FTD或FTD-GRN的进展。此次公布的数据显示,与基线时和安慰剂相比,接受TAK-594/DNL593治疗的患者脑脊液中测量的PGRN水平呈剂量依赖性地增加,且超过了临床前模型中认为治疗PGRN缺乏相关的缺陷所必需的水平,表明该疗法实现了有效的大脑递送。此外,单剂量DNL593通常耐受性良好。这些数据为研究的B部分中对FTD-GRN突变患者进行治疗提供了参考依据。Sonnet BioTherapeutics公司公布了其免疫治疗候选药物SON-1010在两项1期临床试验的中期数据。SON-1010是一种使用Sonnet的全人源白蛋白结合平台开发的专有人类白细胞介素-12(IL-12),有潜力在节省剂量的同时,提高IL-12的安全性和有效性。此次公布针对健康受试者和晚期实体瘤成年患者的试验结果表明,SON-1010的安全性和耐受性良好,尚未发生剂量限制性毒性。细胞因子数据显示,SON-1010具有延长的半衰期,且IFNγ诱导在控制范围内,未出现CRS的迹象。AU-007是通过计算设计的人IgG1单克隆抗体,对IL-2的CD25结合部分具有高度选择性,用于治疗实体肿瘤。AU-007的作用机制不同于任何其他正在开发中的IL-2治疗,它能够在防止IL-2(无论是外源性的还是由T效应细胞分泌的)与调节性T细胞上的三聚体受体结合的同时,仍允许IL-2与T效应细胞和NK细胞结合并使之扩增,从而增强了IL-2的抗肿瘤免疫作用。这种机制防止了其他基于IL-2的治疗引起的负反馈环路,并使免疫系统偏向于激活而不是抑制。AU-007还能够防止IL-2与血管和肺内皮上的三聚体受体结合,有望显著降低与高剂量IL-2治疗相关的血管泄漏综合征和肺水肿。Galecto公司公布了其口服、高亲和力的小分子碳水化合物基半乳糖凝集素-3(Gal-3)抑制剂GB1211,在治疗严重肝脏疾病的1b/2a期临床试验中的积极数据。Gal-3是一种促纤维化β-半乳糖苷结合蛋白,在纤维化的肝脏中高表达,与严重的肝脏疾病相关。GB1211在多个临床前模型中表现出抗纤维化活性和抗癌作用。在此前的针对健康受试者的1期试验中,GB1211具有良好的耐受性,并表现出剂量依赖性的PK。此次公布的研究结果显示,在失代偿期肝硬化患者中,GB1211的耐受性良好,PK可预测,并显示出令人鼓舞的临床疗效迹象——肝脏酶水平和肝脏脂肪水平降低。数据表明,GB1211对严重肝硬化有积极的治疗效果,为GB1211在严重肝脏疾病中的进一步开发提供了有力支持。Stealth BioTherapeutics公司公布了其候选药物SBT-272令人鼓舞的1期临床试验数据。SBT-272是一种靶向富含心磷脂的线粒体内膜的新型小分子药物,该膜对正常的线粒体结构和功能至关重要。临床前研究显示,SBT-272在ALS、FTD、α-突触核蛋白病模型中具有线粒体保护和神经保护作用。此次公布的1期数据显示,该临床试验中所选的剂量,有望在大脑中达到有效治疗浓度。虽然最终的安全性分析正在进行中,但目前临床评估确定的剂量水平,显示可能是安全的,且耐受性良好。近期,SBT-272还获得了FDA授予的孤儿药资格,用于治疗ALS患者。VRG50635是一款潜在“best-in-class”的PIKfyve小分子抑制剂,用于治疗肌萎缩侧索硬化(ALS)。ALS是一种进行性神经退行性疾病,影响大脑和脊髓中的神经细胞,目前尚不清楚其确切的发病机制。该公司基于人体组织和人类数据,通过AI赋能的技术平台CONVERGE发现内体/溶酶体功能的丢失是ALS的新致病机制,并发现PIKfyve是具有潜力的新治疗靶点。VRG50635是一款强力PIKfyve抑制剂,能够恢复ALS患者神经元的内体/溶酶体功能。临床前研究显示,VRG50635在ALS相关运动神经元退化模型中显示出效力。BMF-219是一种特异性抑制menin的小分子抑制剂。目前正在一项针对2型糖尿病的1/2期临床试验以及1项针对慢性淋巴细胞白血病(CLL)的1期临床试验中进行评估。β细胞丢失是1型和2型糖尿病的关键病因。BMF-219旨在通过恢复患者的胰岛β细胞库来为糖尿病患者提供长期的血糖控制能力。Menin被认为是胰腺中β细胞恢复的刹车,抑制menin有可能使正常、健康的β细胞再生。临床前研究表明,BMF-219具有恢复功能性β细胞的潜力。此外,临床前数据还显示,在临床可达到的浓度下,BMF-219能够对多种不同遗传风险和Rai分期的CLL模型中超过98%的细胞具有杀伤力。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。










{replyUser1} 回复 {replyUser2}:{content}