降低潜在致病蛋白88%的RNAi疗法、可穿越血脑屏障的基因疗法... | 一周盘点
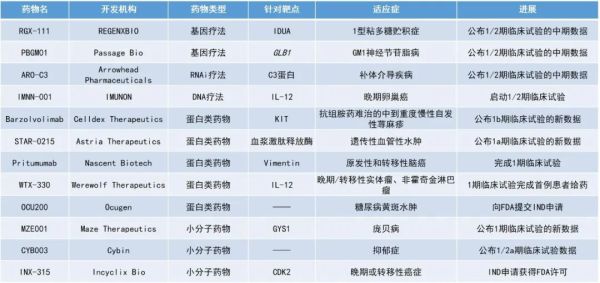
1. 靶向C3蛋白的在研RNAi疗法ARO-C3的早期临床数据积极,最高剂量组患者的C3蛋白水平平均降低88%。
2. 用于治疗重症1型粘多糖贮积症(MPS I)的候选基因疗法RGX-111的早期临床结果显示,该疗法能透过血脑屏障,使患者的中枢神经系统(CNS)状况保持良好。
3. 用于治疗难治性中到重度慢性自发性荨麻疹(CSU)的单抗barzolvolimab公布积极数据,24周时,除开还在随访的最高剂量组,其余患者中53%实现了完全缓解(CR),70%的患者的疾病控制良好。
药明康德内容团队整理
ARO-C3:公布1/2期临床试验的中期数据

Arrowhead Pharmaceuticals公司公布了其在研RNAi疗法ARO-C3在1/2期临床试验中获得的积极中期结果。补体介导疾病包括IgA肾病、C3肾小球病、阵发性睡眠性血红蛋白尿和其他肾脏和血液学适应症。虽然目前已经有靶向C5蛋白的疗法获批上市,但是这一领域仍然具有未满足医疗需求。ARO-C3是一款靶向补体蛋白C3的RNAi疗法,通过与编码C3蛋白的mRNA结合,抑制C3蛋白的表达。由于C3蛋白在补体信号通路中位于C5蛋白的上游,Arrowhead认为它在治疗多种补体介导疾病中具有潜力。
此次公布的数据显示,ARO-C3使血清中C3蛋白水平出现剂量依赖性降低,最高剂量组平均降低88%;使替代补体通路溶血活性的生物标志物AH50的水平出现剂量依赖性降低,最高剂量组平均降低91%。此外,药效持续的时间支持每季度或更长间隔进行一次皮下注射。安全性和耐受性方面,没有发现剂量限制性毒性以及严重不良事件(SAE),或因为不良事件导致的研究中断。
RGX-111:公布1/2期临床试验的中期数据

REGENXBIO公司公布了其候选基因疗法RGX-111治疗重症MPS I的1/2期试验的积极中期数据。MPS I是一种罕见的常染色体隐性遗传病,由α-L-艾杜糖苷酸酶(IDUA,一种有助于分解细胞内长链糖的必需酶)缺乏引起。IDUA缺乏会导致包括硫酸乙酰肝素(HS)在内的糖胺聚糖(GAG)在组织中积累,最终导致细胞、组织和器官功能障碍,这其中也包括CNS。目前,MPS I的治疗方法包括造血干细胞移植(HSCT)和静脉注射酶替代疗法(ERT),但均存在局限性。
RGX-111是一种旨在使用AAV9载体将IDUA基因递送到CNS的基因疗法,使CNS细胞能够长期生产IDUA,可能有助于防止MPS I患者中发生的认知缺陷的进展。目前,RGX-111已获得FDA授予的孤儿药资格,罕见儿科疾病认定和快速通道资格。此次公布的结果显示,RGX-111在两个剂量水平上耐受良好,没有与药物相关的SAE。生物标志物和神经发育数据持续表明RGX-111给药患者的CNS状况令人鼓舞。
Barzolvolimab:公布1b期临床试验数据

Celldex Therapeutics公司公布了其人源化的单克隆抗体barzolvolimab用于治疗抗组胺药难治的中到重度慢性自发性荨麻疹患者的1b期临床试验数据。Barzolvolimab能够高特异性地与维持肥大细胞功能和存活所必须的受体酪氨酸激酶KIT相结合,并能潜在地抑制其活性。KIT在包括肥大细胞在内的多种细胞中表达,能够介导炎症反应(例如超敏反应和过敏反应)。KIT信号控制着肥大细胞的分化、组织募集、存活和活性。在某些像慢性荨麻疹之类的炎症性疾病中,肥大细胞的激活在疾病的发生和发展中起着重要作用。
此次公布的数据显示,在多个给药组中观察到barzolvolimab快速、深刻和持久的反应以及良好的安全性。在治疗12周时,所有剂量组中有56%的患者获得了CR,76%的患者的疾病控制良好。在治疗24周时,除了最高剂量组仍在随访中,其余剂量组的患者中有53%获得了CR,70%的患者的疾病控制良好。该研究中,37%的患者既往接受过omalizumab治疗,与总体人群相比仍有类似的临床获益改善。Barzolvolimab的安全性和耐受性良好,大多数不良事件(AE)的严重程度为轻度或中度,并在研究期间消退。这些数据支持了正在进行的慢性荨麻疹2期临床试验,并有望将barzolvolimab的开发扩展到其他肥大细胞相关适应症。
PBGM01:公布1/2期临床试验的新中期数据
Passage Bio公司公布了其针对GM1神经节苷脂贮积症的基因疗法PBGM01早期临床试验的积极中期结果。GM1神经节苷脂贮积症是一种罕见的单基因溶酶体贮积症,是由编码溶酶体酶β-半乳糖苷酶(β-gal)的GLB1基因突变所引起的。PBGM01利用了新一代载体AAVhu68的病毒衣壳,经小脑延髓池注射给药,将编码β-gal的功能性GLB1基因输送到大脑和外周组织。通过增加β-gal的活性,PBGM01有望减少毒性GM1神经节苷脂的积累、逆转神经元的毒性,从而恢复其发育潜力。
此前公布的数据显示,这种基因疗法可以显著改善婴儿期GM1神经节苷脂贮积症患者的疾病相关标志物水平和临床表现,并且具有良好的安全性;给药后患者脑脊液β-Gal活性出现剂量依赖性增加,接受高剂量治疗的患者的酶活性增加远高于基线值;PBGM01的给药也会导致脑脊液中GM1神经节苷脂水平呈现剂量依赖性下降。
最新公布的数据显示,来自前6名患者的其他生物标志物和疗效数据继续证明,高剂量和低剂量的PBGM01均能导致患者产生生物效应。在随访6至12个月时,PBGM01给药使所有接受治疗患者的MRI严重程度评分(用于评估GM1患者脑容量和白质完整性)稳定。在晚期婴儿GM1患者的自然病程数据中,在6个月至4年的随访期间,该评分会增加。
IMNN-001:启动1/2期临床试验
IMNN-001是IMUNON公司开发的一种基于DNA的IL-12免疫疗法,用于治疗晚期卵巢癌的局部治疗。IMNN-001采用IMUNON专有的TheraPlas平台技术设计,是一种包裹在纳米颗粒递送系统中的IL-12 DNA质粒载体,可实现细胞转染,然后使局部组织持续分泌IL-12蛋白。该公司之前报告称,IMNN-001作为单一疗法或联合疗法用于晚期腹膜转移原发性或复发性卵巢癌症患者具有积极的安全性,取得了令人鼓舞的1期试验结果,并已完成了IMNN-001与卡铂和紫杉醇联合治疗新确诊卵巢癌症患者的1b期剂量递增试验。近日,该公司宣布启动一项新的1/2期临床试验的患者招募,以评估IMNN-001联用贝伐珠单抗治疗晚期卵巢癌症患者的疗效。
STAR-0215:公布1a期临床试验的新数据
Astria Therapeutics公司公布了其血浆激肽释放酶单克隆抗体抑制剂STAR-0215在健康受试者中的1a期临床试验的初步数据。该候选疗法旨在治疗遗传性血管性水肿(HAE)。结果显示,STAR-0215具有作为长效血浆激肽释放酶抑制剂的潜力,半衰期长达117天,支持STAR-0215每三个月给药一次或以更低的频率给药。根据该结果,Astria公司在这项1a期试验中新增了队列,以评估每6个月1次的给药频率的潜力,预计将于今年第四季度公布结果。此外,该公司于上月宣布了启动在HAE患者中开展的1b/2期试验。
Pritumumab:完成1期临床试验
Pritumumab(PTB)是Nascent Biotech公司发现的一种天然的人类抗体,可与一种在上皮癌细胞表面表达的蛋白质Vimentin结合。PTB旨在作为一种只针对癌细胞而不损害健康细胞的靶向免疫疗法。Nascent公司于近日宣布,已完成Pritumumab用于治疗原发性和转移性脑癌的1期安全性试验,将继续收集和评估该试验中产生的数据,以支持其2期试验的开展。
WTX-330:1期临床试验完成首例患者给药
WTX-330是Werewolf Therapeutics公司开发的全身递送的条件激活型IL-12疗法。该疗法的条件激活特性能够避免阻断正常组织中的IL-12R受体,以将IL-12的全部作用直接递送至肿瘤微环境。该公司于近日宣布,在晚期/转移性实体瘤或非霍奇金淋巴瘤患者中开展的1期临床试验已完成首例患者给药。该临床试验将评估WTX-330在这些患者中的安全性、耐受性及临床活性。
OCU200:向FDA提交IND申请
OCU200是Ocugen公司开发的一种具有独特作用机制(MOA,mechanism of action)的融合蛋白,用于治疗糖尿病黄斑水肿(DME)。OCU200由人转铁蛋白与人肿瘤抑制素(tumstatin)连接而成,通过选择性靶向视网膜和脉络膜组织发挥抗增殖、抗炎和抗氧化作用。由于转铁蛋白的存在,OCU200可能显示出比单独使用肿瘤抑制素更好的生物利用度和组织渗透性,并通过αVβ3整合素途径提供了明显的MOA结合,从而可能减少患者的注射次数。该公司于近日向FDA递交了IND申请,以寻求开展1期临床试验。
MZE001:公布1期临床试验的新数据
Maze Therapeutics公司公布了其针对庞贝病(Pompe disease)所开发的在研小分子抑制剂MZE001于临床1期试验中的积极结果。庞贝病是由于缺乏酸性α-葡萄糖苷酶(GAA)引起的遗传性溶酶体储存障碍。ERT是目前唯一获批的疗法,但仍有未满足的临床需求。MZE001是一种口服糖原合成酶1(GYS1)抑制剂,旨在抑制庞贝病的致病原因——糖原累积。此次公布的数据分析显示,MZE001在每日两次720 mg的剂量下耐受良好。研究人员使用了一种新型生物标志物——外周血单核细胞(PBMC)糖原对MZE001在受试者中的疗效进行了评估。给药10天后,各剂量水平下PBMC糖原呈暴露依赖性降低,这证实了MZE001与GYS1的靶向结合。
CYB003:公布1/2a期临床试验数据
Cybin公司公布了其专有的氘代裸盖菇素类似物CYB003用于治疗抑郁症的早期临床数据。结果显示,CYB003使受试者出现了快速和短效的迷幻反应,并在单次给药8 mg和10mg的低剂量下展现出了有意义且强大的迷幻效果。此外,CYB003的安全性和耐受性良好。
INX-315:IND申请获得FDA许可
INX-315是Incyclix Bio公司开发的新型选择性细胞周期蛋白依赖性激酶2(CDK2)抑制剂,在临床前研究中表现出令人信服的疗效和安全性数据。CDK2是癌细胞增殖的已知驱动因素,也是具有广泛临床潜力的靶标。近日,Incyclix公司宣布FDA已批准了INX-315的IND申请,并将在2023年第一季度启动其首个人体1/2期临床试验。该试验将在接受过CDK4/6i方案并进展的ER+/HER2-乳腺癌患者以及接受过标准治疗并进展的CCNE1扩增的实体瘤患者中进行。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}