|
2024-04-06 22:07:11
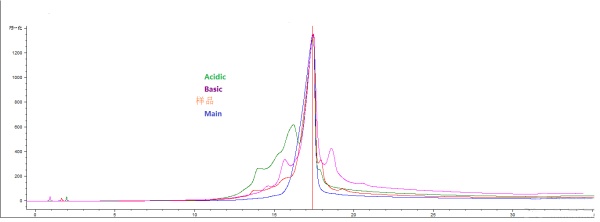
抗体电荷异构体之间是否存在相互转化问题?如题,碰到的个问题,我用制备型HPLC分别分离收集酸碱性异构体,按照主峰峰谷收集,之后进行浓缩,去分析型检测,所用柱子介质一致,只是体积不同。如图所示 结果虽然酸性异构体中酸性组分明显变多,但仍存在目的组分。目的组分纯度将近100,收集的碱性异构体更加神奇,酸性组分与碱性组分均增加。目的组分的出现比较合理,收集碱性组分时,不应该还存在酸性组分。
所以请教各位大神,是否有看到类似文献说酸碱性异构体之间会相互转换 ?我个人知识,也许会有转换,比如C端赖氨酸存在显碱性峰,过程中被切除变成酸性异构体?只是原先结果显示该蛋白赖氨酸已经大部分被切除 。 |
4个回答
|
楼主提出了一个很有意思的问题。我的看法如下: 1.色谱左拖尾很可能是由于样品浓缩后上样量太大引起的。 2.酸碱组分在第一步分离的效果确实不够好,但是无论如何差,都不能解释为何“碱性异构体更加神奇,酸性组分与碱性组分均增加” 3.上述貌似神奇的现象很可能确如楼主推测的:“酸碱性异构体之间会相互转换”。至少碱性成分可以转化为酸性成分。在楼主浓缩过程中,有些影响酸碱性异构体的成分(如铜离子)会大大增加,从而导致碱性成分转化为酸性成分。 4.支持文献:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242844/ 5.上述文献相关关键结果:“While the acidic charge variant profile remained unchanged for all copper concentrations, the relative abundance of certain basic peaks increased with increasing copper concentration over the range tested。” 6.单抗电荷异构体的形成原因有很多(Heterogeneity in mAbs is represented by charge variants, typically caused by deamidation, isomerization, succinimide formation, oxidation, sialylation, N-terminal pyroglutamic acid or C-terminal lysine (Lys) clipping)。所以有许多可能的因素会导致碱性成分转化为酸性成分。 |
|
不知你上样量是多大,还有你的分析方法好像不好吧,看过很多色谱图,很少看见像你这样的色谱图,均向右倾斜,并且,右面几乎不拖尾,一般的色谱图要是拖尾都是右变的;另外酸碱组分很难分开的,等电点一般就差0.1,不过如果你分离方法好的话,还是可以得到的,见过文献上的分析图谱,分离效果不错,后面2个碱性峰的保留时间能相差1min左右,人家用的是WCX。 |
|
现在主流的测电荷异质性是通过离子柱来分析,但是它的分辨率达不到我们理想中的要求(峰之间完全分离),但是这是现状,所以技术还有待进一步发展。既然分辨率达不到完全分离,那么表明组分之间没有完全分离,完全有可能酸性峰有碱性峰,碱性峰中有酸性峰(如果做过纯化,可能理解会更深刻)。个人认为,这种情况很正常。另外酸性峰,主峰,碱性峰不是纯物质,它们是一堆混合物,他们之间含量的变化是很复杂的。一点个人浅见。 |
|
charge variants的分离我觉得还是displacement chromatography效果最好。另外,这个图谱确实不正常,整体偏右。现在国内做抗体药的,都没有人是全部都懂的,做培养的也许只知道发酵,但是对蛋白质的性质完全不了解,做纯化的也未必深度了解蛋白质。药物分析这块呢多数是以前做小分子的,后来转做大分子,方法虽然大同小异,但是蛋白质的复杂性决定了分析的复杂。每个部分如果没有一个牛人支持,基本就搞不成。7楼这个确实很有意思,我以前确实碰到过这种蛋白,离子柱可以分得很好,但是后面每一个单独组分再分析又变了,不过这样的抗体确实没碰到过。按道理,抗体的charge variant虽然有多种成因,但是在下游纯化完成后最容易发生的也就是oxidation和deamidation了,有些可能还有Asp的isomerization啥的。倒是可以分析抗体里面是否含有这种金属离子导致构象出现了变化。 |
你的回答
| 提问时间: | 2024-04-06 |
| 浏览量: | 4158 |
| 最近回答: | 2024-04-07 |