罗氏2023年度财报公布,哪些创新疗法将在2024迎来里程碑?
近日,罗氏(Roche)公布了2023年度的财务报告,详细介绍了其研发管线布局及其最新进展。在今天的文章中,药明康德内容团队将为读者解读其中的精彩亮点。

回顾2023年,罗氏集团首席执行官Thomas Schinecker博士表示,罗氏在监管、临床研究开发和重大交易方面取得了显著成就,展望未来,罗氏旗下两款新药crovalimab和inavolisib有望在2024年迎来监管批准,这两款药物分别针对阵发性睡眠性血红蛋白尿症(PNH)和激素受体阳性(HR+)、人表皮生长因子2阴性(HER2-)局部晚期或转移性乳腺癌患者的治疗。罗氏计划在其专注的五个关键领域——肿瘤学/血液病学、神经科学、免疫学、眼科学以及心血管和代谢疾病领域继续推进创新,并预计在2024至2025年期间取得一系列重要的研发进展。

▲罗氏在研药物研发计划表(图片来源:参考资料[1])
肿瘤学/血液病学领域
罗氏旗下在研PI3Kα小分子抑制剂inavolisib目前正处于3期临床开发阶段,这包括一项关键性头对头试验,旨在评估inavolisib与CDK4/6抑制剂Ibrance(palbociclib)和氟维司群(fulvestrant)联用,一线治疗HR+、HER2-局部晚期或转移性乳腺癌患者的疗效。这些患者携带PIK3CA突变,并且对内分泌疗法产生耐药性。
最新公布的临床数据显示,与Ibrance和氟维司群联用的对照组相比,含有inavolisib的组合疗法可将疾病进展风险降低57%(HR=0.43),尽管目前总生存期(OS)数据尚不成熟,但初步结果已展现出积极趋势(HR=0.43)。罗氏计划将这些结果递交给监管机构,以期为PIK3CA突变的HR+乳腺癌患者提供一种潜在的新治疗方案。
除了上述研究外,还有两项针对PIK3CA突变乳腺癌的3期研究——INAVO121和INAVO122正在进行中。INAVO121研究旨在对比inavolisib联合氟维司群与alpesilib联合氟维司群的治疗效果,目标群体是HR+、HER2-且携带PIK3CA突变的局部晚期或转移性乳腺癌患者。INAVO122研究则将inavolisib与Phesgo联合用药方案与安慰剂+Phesgo联合方案进行比较,以评估其作为携带PIK3CA突变的HER2+晚期乳腺癌患者一线维持治疗的效果。
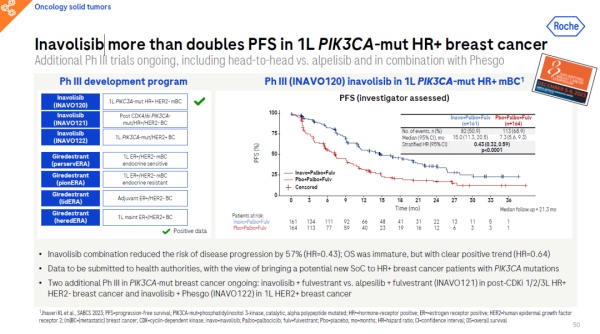
▲Inavolisib治疗乳腺癌的试验结果(图片来源:参考资料[1])
罗氏的重磅产品trastuzumab emtansine(商品名:Kadcyla)是一款靶向HER2的抗体偶联药物(ADC),这款药物由两部分组成:它的一端是靶向HER2的抗体trastuzumab,另一端则连有化疗药物DM1。按设想,这种药物能结合表达HER2的癌细胞,将强效化疗药物直接递送到HER2阳性肿瘤细胞中,并对其进行杀伤。
该报告指出,Kadcyla已在全球范围内治疗了超过8万名患者,在3期临床试验中,Kadcyla显著改善了早期乳腺癌患者的OS(HR=0.66)。长期数据还表明,患者的无浸润性疾病生存期(iDFS)持续获益(HR=0.54)。同时,Kadcyla的安全性与之前的研究结果一致,没有发现新的安全信号。
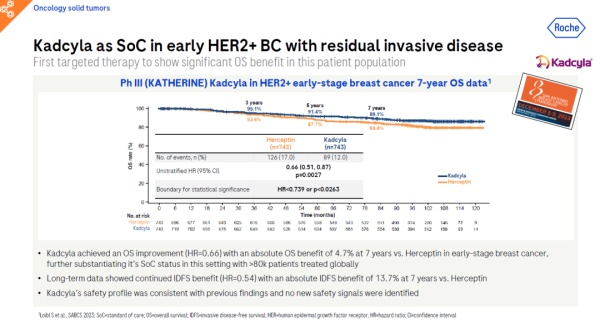
▲Kadcyla治疗早期乳腺癌患者的试验数据(图片来源:参考资料[1])
在血液学领域,罗氏的多款已上市及在研药物均展现了令人瞩目的临床进展,预计2024年将有若干药物获得新的监管批准。具体来说:
罗氏研发的双特异性凝血因子IXa和因子X抗体Hemlibra正在积极拓展其适用范围。目前,全球已有大约2.4万名患者接受了Hemlibra治疗。尤其值得关注的是,Hemlibra治疗血友病A婴儿患者的3期临床试验HAVEN 7的结果已在2023年美国血液学会(ASH)上公布,研究发现,对于血友病A的婴儿患者,出生后不久即开始皮下注射Hemlibra可以有效降低颅内出血和关节出血的风险,从而在损伤发生前提供保护。初步分析表明,Hemlibra对患有严重血友病A的婴儿有效且耐受性良好。
此外,罗氏还预计其补体C5蛋白抗体crovalimab在2024年能够获得美国或欧洲的监管批准,用于治疗PNH。与此同时,三项3期临床试验——STARGLO、SUNMO和VERONA——预计将发布新的临床数据,进一步证实这些药物的疗效和安全性。
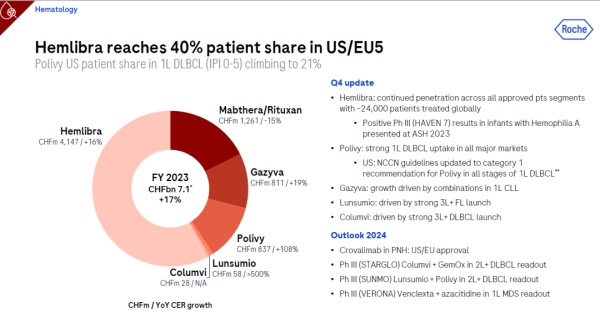
▲2023年度,罗氏在血液病学领域的管线进展(图片来源:参考资料[1])
神经科学领域
在神经科学领域,罗氏正在开发一款名为trontinemab的创新单克隆抗体药物。Trontinemab运用罗氏大脑穿梭(brain shuttle)技术,靶向淀粉样蛋白。它将靶向淀粉样蛋白的单克隆抗体与可以和转铁蛋白受体相结合的蛋白域融合,这一设计使其能够有效地穿过血脑屏障,直达大脑内部。
在进行的1b/2a期临床试验中,trontinemab展示了其与传统Aβ单克隆抗体相比的显著优势:与典型的Aβ单抗相比,trontinemab以相对较低的剂量就能快速、稳健地减少淀粉样斑块。在经过28周最高剂量(1.8 mg/kg)药物治疗下,有75%患者的淀粉样蛋白水平降至正常检测水平之下。这些中期药效学和安全性数据为在当前1b/2a期试验中进行进一步研究提供了支持。罗氏计划在即将召开的阿尔茨海默病与帕金森病国际大会(AD/PD)上公布这项临床试验的最新成果。
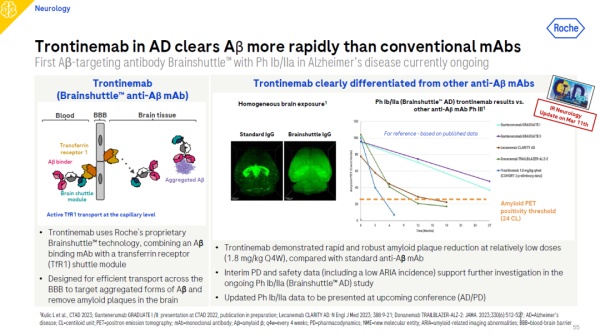
▲Trontinemab治疗阿尔茨海默病的试验数据(图片来源:参考资料[1])
免疫学领域
罗氏已向美国FDA提交了Xolair(omalizumab)的补充生物制品许可申请(sBLA),该申请已获得优先审评资格,用于减少成人和1岁以上儿童因意外暴露于一种或多种食物而可能发生的过敏反应,包括过敏性休克。罗氏强调,如果获批,Xolair将成为首个在对多种食物过敏的患者中,减少因意外暴露所产生过敏反应的药物。FDA预计将在2024年第一季度作出批准决定。

▲Xolair有望迎来监管里程碑(图片来源:参考资料[1])
此外,罗氏正在开发的潜在“first-in-class”药物——TL1A抗体RVT-3101——预计将启动3期临床试验,旨在治疗溃疡性结肠炎患者。TL1A可以与DR3受体结合,刺激下游的炎症和纤维化过程,而TL1A的失调被发现与多种免疫介导疾病的发生有关。因此,阻断TL1A通路被视为治疗炎症性及纤维化疾病的一个新策略。
在针对溃疡性结肠炎的2b期临床试验中,从诱导阶段到维持阶段,接受RVT-3101治疗的患者临床缓解率(75%)和内镜改善率(80%)持续上升,同时,该药物在试验中表现出了良好的安全性和耐受性。罗氏在其报告中表示,抗TL1A疗法有望改善多种自身免疫性疾病的临床疗效。
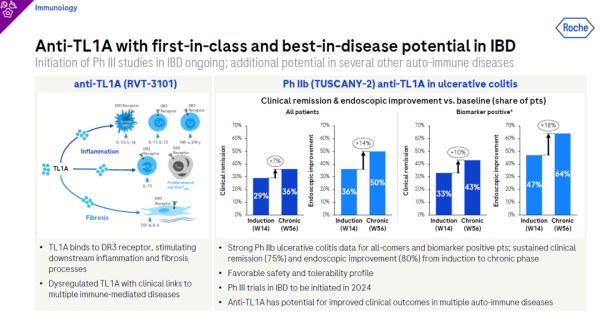
▲TL1A抗体疗法治疗溃疡性结肠炎的试验数据(图片来源:参考资料[1])
眼科领域
罗氏的双特异性抗体Vabysmo(faricimab)在2023年取得了诸多进展。该抗体可同时靶向阻断两条致病关键通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。Vabysmo通过同时靶向这两条途径,具有潜在的协同作用,有望稳定血管并改善患者的视力。在2023年10月,该抗体获得美国FDA批准用于治疗视网膜静脉阻塞(RVO),比预期的PDUFA日期提前了2个月。
展望2024年,Vabysmo针对RVO的适应症有望在欧盟获得批准。同时,罗氏正在开发白介素-6(IL-6)抗体vamikibart,旨在治疗糖尿病性黄斑水肿(DME),以及针对因子B(factor B)的反义寡核苷酸(ASO)疗法,用于治疗地图样萎缩(GA),这两项疗法都将在今年迎来新的临床数据更新,这对于这些疾病的患者来说是一个积极的信号。

▲2023年度,罗氏在眼科学领域的管线进展(图片来源:参考资料[1])
心血管和代谢疾病领域
去年12月,罗氏宣布与Carmot Therapeutics达成最终合并协议,并将其研发管线纳入囊中,其中包括三款疗法:CT-388、CT-996和CT-868。
CT-388是一种准备进入2期临床开发阶段的GLP-1/GIP受体双重激动剂,用于治疗无论是否患有2型糖尿病的肥胖患者。该药物每周皮下注射一次,不仅有望成为独立治疗方式,还可与其他疗法结合使用,以改善体重减轻效果,并可能扩展至其他适应症。预计到2024年,CT-388的相关临床试验将公布1期临床试验的最终结果。
CT-996是一种每日一次口服的小分子GLP-1受体激动剂,目前处于1期临床试验阶段,旨在治疗无论是否患有2型糖尿病的肥胖患者。罗氏计划在2024年公布该药物的中期临床数据。
CT-868则是一款处于2期临床试验阶段的每日一次皮下注射的GLP-1/GIP受体双重激动剂,专门用于治疗患有1型糖尿病的超重或肥胖患者。预期在2024年将会发布该药物2期试验的中期数据。
罗氏在肥胖治疗领域的研发计划展现了初步但令人鼓舞的结果。在CT-388的1/2期临床试验中,该药物表现出良好的耐受性,其药代动力学特征支持每周一次的给药频率。初步结果显示,经CT-388治疗的患者在4周内平均体重减轻了8.4%,相当于15.4斤,同时显示出腰围和臀围的减少以及胰岛素敏感性标志物HOMA-IR的改善。

▲2023年度,罗氏在肥胖治疗领域的管线进展(图片来源:参考资料[1])
除了上述内容,此次罗氏发布的年度财务报告还涵盖了罗氏在不同领域的研发管线详细进展,以及已上市疗法的研发成果和市场表现。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}