SCI新宠——m6A了解一下!?
表观遗传学是指在DNA序列不改变的情况下,基因功能发生的可遗传的变异,最终可导致表型变化,包括DNA表观遗传学以及RNA表观遗传学。
目前,约 150种RNA修饰方式已被鉴定参与不同类型的RNA的转录后修饰,包括信使RNA(mRNA),转运RNA(tRNA),核糖体RNA(rRNA),小分子非编码RNA(microRNA)和长链非编码RNA(lncRNAs)。其中,m6A(N6-甲基腺嘌呤)是最常见的真核生物mRNA转录后修饰形式之一。
m6A是指发生于腺嘌呤的第6位氮原子(N)上的甲基化修饰。是一种动态可逆的修饰方式,通过甲基化酶复合物进行甲基的“书写”,脱甲基酶进行甲基的 “擦除”,以及特定的蛋白质来与之结合“阅读”,进而调控基因表达、剪接、RNA 编辑、RNA 稳定性、控制mRNA寿命和降解、介导RNA翻译等生物学过程 [1]。
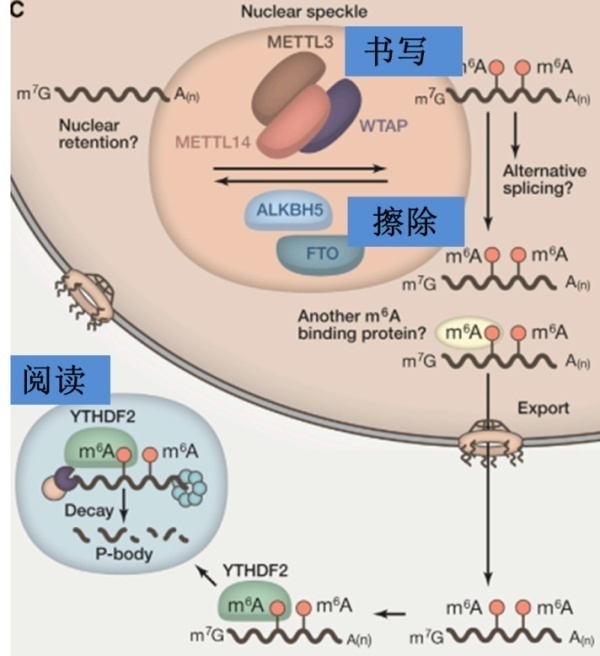
m6A甲基化修饰受到多种组分的调控[2],包括:
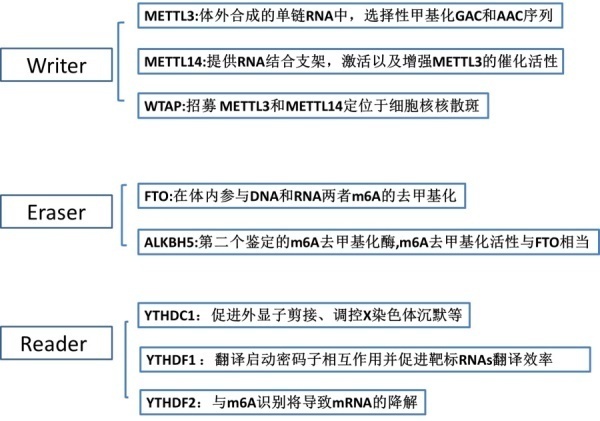
1. “Writer”:
RNA甲基化转移酶, METTL3、 METTL14、WTAP、KIAA1429、RBM15、ZC3H13等,负责在RNA上加上甲基,介导甲基化过程。
2. “Eraser”:
去甲基化酶包括FTO和ALKBH5,参与去除RNA上的甲基,介导去甲基化过程。
3. “Reader:
RNA结合蛋白,包含YTH家族的成员:YTHDF1,YTHDF2,YTHDF3和YTHDC2,参与RNA识别以及结合。
近年来,m6A生物学功能已备受关注,并成为生命科学热门研究领域之一。
1
2017年Nature杂志研究发现m6A依赖的RNA降解,是一种调节母源mRNA清除的新机制[3]。众所周知,“受精”是雌雄生殖细胞融合而产生新生命的过程,受精卵早期发育阶段,成熟的卵母细胞中储备了大量母源因子,为受精后早期胚胎快速发育提供所需的RNA和蛋白质。在受精后一段时间内,母源性mRNA和蛋白质被消耗殆尽或者发生主动降解,胚胎基因组才被激活,发育程序才处于胚胎自身基因的调控之下,即母源因子-合子基因组转换(MZT)。母源因子的有效清除,才能保证胚胎的继续发育。
在作者研究中发现Ythdf2在整个早期胚胎发育中广泛表达,通过 Ythdf2-/-雌性斑马鱼与野生型雄性斑马鱼交配(图1),阻碍了母源因子-合子基因组转换,导致胚胎发育停滞(图2)。而向Ythdf2-/-胚胎中注射GFP-m6A-mRNA(图3),发现Ythdf2-/-GFP的荧光强于对照组,外源性m6A-mRNA降解速度降低。证明m6A修饰的mRNA的降解是Ythdf2依赖性的(图4)。作者提出Ythdf2在MZT 过程中参与母源mRNA的清除。

2
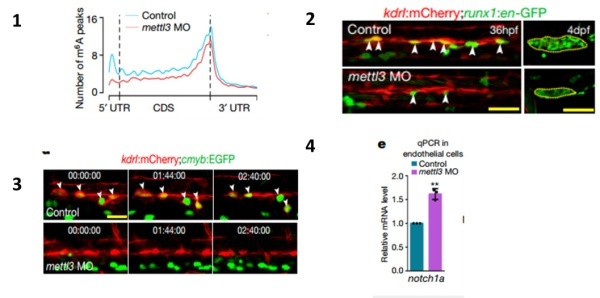
2017年Nature杂志发表的研究成果表明,m6A能在斑马鱼的胚胎发育内皮细胞向造血细胞转变(EHT)过程中,影响最早的造血干细胞/祖细胞(HSPC)的命运[4]。作者通过通过敲减胚胎内甲基转移酶Mettl3,引起m6A峰值水平降低(图1),结果显示胚胎中胚层的形成不受影响,但内皮细胞和造血干细胞HSPCs的数量显著减少(图2)、内皮细胞未能转化为造血细胞(图3)。进一步的机制研究显示m6A峰值降低可以引起notch1a表达升高(图4),进而抑制血管内皮细胞向HSCs转化。提示 m6A修饰在胚胎发育内皮细胞向造血细胞转变过程中起到平衡作用,决定造血祖细胞命运。
3
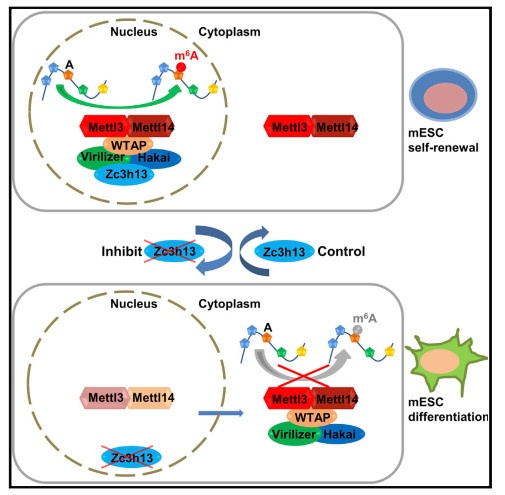
2018年5月15日发表在Molecular Cell杂志研究发现:锌指蛋白Zc3h13能够与WTAP,Virilizer,蛋白互作。在小鼠胚胎干细胞中敲除Zc3h13可以引起mRNA m6A水平显著降低,同时导致WTAP,Virilizer以及Hakai定位转移至细胞质内,改变干细胞的形态并减少mESC自我更新能力,同时还可以触发mESC的分化。以上结果证明Zc3h13在将WTAP,Virilizer和Hakai锚定在细胞核中以及促进m6A甲基化和调节mESC自我更新方面起关键作用[5]。
通过以上的内容,可以发现m6A的在胚胎发育、干细胞分化、造血系统、免疫系统都发挥着十分重要的生物学功能,m6A的研究促进了表观遗传学的发现,对于其新的调控机制尚待进一步的发现。
参考文献
1. Yang Ying,Hsu Phillip J,Chen Yu-Sheng et al. Dynamic transcriptomic mA decoration: writers, erasers, readers and functions in RNA metabolism.[J] .Cell Res., 2018, 28(6): 616-624.
2. Lee Mihye,Kim Boseon,Kim V Narry. Emerging roles of RNA modification: m(6)A and U-tail.[J] .Cell, 2014, 158(5): 980-987.
3.Zhao Boxuan Simen,Wang Xiao,Beadell Alana V et al. mA-dependen maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition.[J] .
Nature, 2017, 542(7642): 475-478.
4.Zhang Chunxia,Chen Yusheng,Sun Baofa et al. mA modulates haematopoietic stem and progenitor cell specification.[J] .Nature, 2017, 549(7671): 273-276.
5.Wen Jing,Lv Ruitu,Ma Honghui et al. Zc3h13 Regulates Nuclear RNA mA Methylation and Mouse Embryonic Stem Cell Self-Renewal.[J] .Mol. Cell, 2018, 69(6): 1028-1038.e6.


{replyUser1} 回复 {replyUser2}:{content}