上海科大与中国科学院研究组合作开发出普适型碱基编辑器

封面配图由上海科技大学2018届硕士毕业生袁一中绘制
近年来,将CRISPR/Cas 基因编辑酶(如CRISPR/Cas9、CRISPR/Cpf1等)与核酸脱氨编辑酶(如胞嘧啶脱氨酶APOBEC/AID、腺嘌呤脱氨酶ADAR等)整合发展出的碱基编辑系统(Base Editor, BE),可在单碱基水平(C-to-T、A-to-G)对基因实现高效率的靶向编辑改造【1-6】。这种新型碱基编辑系统理论上可对数百种引起人类疾病的基因组单碱基突变进行定点矫正,因此拥有巨大的临床应用潜力。碱基编辑技术于2017年被Science杂志评为全球10大年度科学突破之一,进一步凸显出该领域在科学研究和临床应用上的重要潜力。
尽管在David Liu等人努力下可以实现,单碱基的自由替换【7】,然而由于某些人类疾病中可能出现的碱基T到C的突变而且处于易被DNA甲基化修饰的CpG二核苷酸位点,因此目前基于APOBEC1/AID脱氨酶的单碱基基因编辑方法在遇到甲基化修饰的CpG二核苷酸位点时其效率会大幅降低(在哺乳动物基因组中,CpG位点的胞嘧啶通常易被甲基化修饰),受到较大的限制,原因是APOBEC1/AID脱氨酶的活性会收到甲基化DNA的抑制【8】。
上海科技大学生命科学与技术学院陈佳教授研究组、黄行许教授研究组与中国科学院-马普计算生物学研究所研究员杨力研究组开展合作研究,成功开发出一系列基于人胞嘧啶脱氨酶APOBEC的新型普适碱基编辑器,其中基于人APOBEC3A(hA3A)的碱基编辑器可高效介导甲基化胞嘧啶mC到胸腺嘧啶T的编辑,相关工作于北京时间8月20日以Efficient base editing in methylated regions with a human APOBEC3A-Cas9 fusion为题在Nature Biotechnology上在线发表。

在这项最新的研究中,合作团队首先利用生物信息学方法系统分析了与人类疾病相关的单碱基突变,发现胸腺嘧啶T到胞嘧啶C突变中的很大部分处于CpG二核苷酸位点(~43%)。
为了实现高甲基化区域内的高效碱基编辑,合作团队成员利用十余种来自不同物种的APOBEC胞嘧啶脱氨酶家族蛋白构建出一系列新型碱基编辑器,可广泛用于胞嘧啶C至胸腺嘧啶T单碱基编辑。更为重要的是,合作团队通过一系列筛选鉴定,发现基于人APOBEC3A的碱基编辑器(hA3A-BE)可在基因组高甲基化区域实现高效的甲基化胞嘧啶mC至胸腺嘧啶T单碱基编辑。
深入研究发现,hA3A-BE是一种普适且高效的碱基编辑器,可在已检测的多种环境中实现胞嘧啶C(或甲基化胞嘧啶mC)至胸腺嘧啶T的高效编辑。最后,通过对人APOBEC3A的系统性改造,研究团队成功缩小了hA3A-BE的编辑区间,进一步提高了其碱基编辑的精度。与之前报道的基于大鼠APOBEC1的碱基编辑器相比,基于人APOBEC3A的新型碱基编辑器应用范围更加广泛和全面,这为碱基编辑系统在基础研究及未来临床领域的全面深入应用提供了新工具、新方法和新思路。
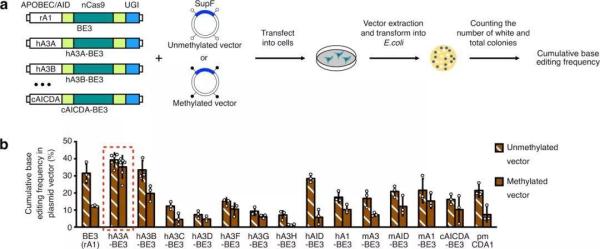
a) 构建多种碱基编辑器并筛选其在高甲基化区域的编辑效率;b) hA3A-BE3能够在高甲基化区域进行高效碱基编辑
据悉,该工作在杨力研究员、陈佳教授、黄行许教授的共同指导下完成。上海科技大学生命学院陈佳研究组2016级硕博连读研究生王潇、黄行许研究组2015级硕博连读研究生李佳楠、免疫化学研究所杨贝博士和中科院计算生物学研究所杨力研究组2015级硕博连读研究生王滢和研究助理韦佳为同等贡献共同第一作者。
值得一提的是,本文的通讯作者之一陈佳博士刚刚获得国家优秀青年科学基金(“优青”)项目支持。近两年来,陈佳博士作为通讯作者已发表多篇高水平研究论文。其中,今年3月份,陈佳研究组、黄行许研究组与杨力研究组合作在Nature Biotechnology杂志上报道了他们开发出一系列基于CRISPR/Cpf1(Cas12a)的新型碱基编辑器(dCpf1-BE);去年12月份,陈佳研究组与杨力研究组以及南京医科大学沈彬研究组合作,在Nature Structural & Molecular Biology上发文共同揭示了胞嘧啶脱氨酶(APOBEC)在CRISPR/Cas9引发的DNA断裂修复过程中产生突变的新机制,并为进一步提高基因组编辑保真度提供了新思路;去年8月,陈佳研究组、杨力研究组与上科大免疫化学研究所副研究员杨贝合作在Cell Research上发文,报道他们开发了一种增强型碱基编辑器(enhanced base editor, eBE),其克服了原有碱基编辑技术保真度较低的缺陷,实现了更高准确度的基因组单碱基编辑。

图为今年5月31日,Cell杂志推出了一篇对话文章,Cell杂志的编辑April Pawluk与陈佳博士(左)、季维智院士(中)以及Prashant Mali(右)对话讨论基因编辑的未来。图片引自:Chen, J., Ji, W., & Mali, P. (2018). The Future of Genome Editing. Cell, 173.

Cell杂志的编辑April Pawluk(左一)与陈佳博士(左二)、Prashant Mali(左三)以及季维智院士(左四)在苏州亚洲冷泉港会议期间(2018年4月23-27日)的合影。图片引自:Chen, J., Ji, W., & Mali, P. (2018). The Future of Genome Editing. Cell, 173.
参考文献
1. Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. & Liu, D.R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature180 533, 420-424 (2016).
2. Nishida, K. et al. Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems. Science 353 (2016).
3. Kim, K. et al. Highly efficient RNA-guided base editing in mouse embryos. Nat Biotechnol 35, 435-437 (2017).
4. Zong, Y. et al. Precise base editing in rice, wheat and maize with a Cas9-cytidine deaminase fusion. Nat Biotechnol 35, 438-440 (2017).
5. Hu, J.H. et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature 556, 57-63 (2018).
6. Li, X. et al. Base editing with a Cpf1-cytidine deaminase fusion. Nat Biotechnol 190 36, 324-327 (2018)
7. Gaudelli, et al. Programmable base editing of A• T to G• C in genomic DNA without DNA cleavage. Nature, 551(7681), 464.(2017).
8. Nabel, C.S. et al. AID/APOBEC deaminases disfavor modified cytosines implicated in DNA demethylation. Nat Chem Biol 8, 751-758 (2012)
来源:BioArt
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}