Cell子刊:超动力自然杀伤细胞CAR-iNKT,更有效的对抗癌症
 近日,来自伦敦帝国学院(Imperial College London)的科研团队发表在《Cancer Cell》期刊上的研究成果表明:一种可大规模生产的超动力自然杀伤细胞(Supercharged NK cells),能够有效对抗癌症。这种个性化治疗涉及免疫细胞重编程,或标志着继CAR-T疗法之后的下一代尖端免疫疗法。
近日,来自伦敦帝国学院(Imperial College London)的科研团队发表在《Cancer Cell》期刊上的研究成果表明:一种可大规模生产的超动力自然杀伤细胞(Supercharged NK cells),能够有效对抗癌症。这种个性化治疗涉及免疫细胞重编程,或标志着继CAR-T疗法之后的下一代尖端免疫疗法。
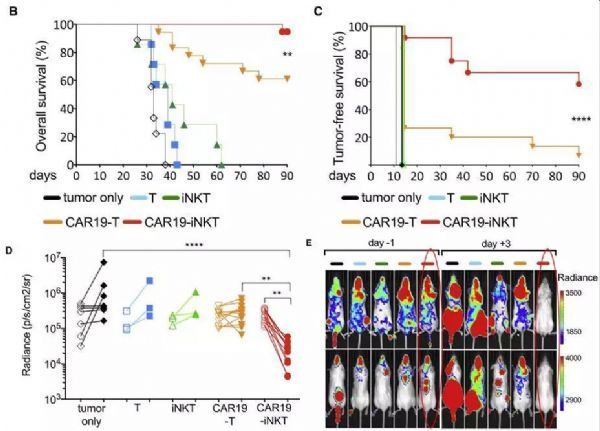
由慈善机构Bloodwise资助的这项最新的研究中,研究人员创建了一种被称之为“CAR19-iNKT”的基因工程版本的细胞。如上图,CAR19-iNKT同时靶向CD19和CD1d,通过其iTCR完整性给予aGVHD(急性移植物抗宿主病)保护,αGalCer和ATRA则对CAR19-iNKT细胞起到反应性增强作用。
众所周知,目前的CAR-T细胞治疗是针对每个癌症患者进行量身定制的,价格非常昂贵,每位患者需要花费约300,000英镑。但当前研究背后的科学家们表示,他们的新型CAR-T疗法或能解决这一棘手的问题,能够批量生产且不再受到个性化的受限制,一批产品能够同时用于多个患者,有望将治疗费用降低十倍。
新的研究显示,CAR19-iNKT消除了60%小鼠体内的所有癌细胞,且90%的小鼠经历了长期存活。目前,研究人员正在考虑进行人体试验。
打造细胞抗癌军队
论文高级作者Anastasios Karadimitris教授说:“早期研究结果表明,这种在实验室经过精心设计的超动力免疫细胞有望成为癌症患者的治疗新选择。
其中CAR(嵌合抗原受体)疗法作为一种新型的免疫疗法,其涉及从患者的血液中提取一种免疫细胞,在实验室中对其进行工程化操作,以获得能够精准识别并破坏癌细胞的超动力免疫细胞。然后,经过工程化的新型抗癌细胞在实验室中进行成倍扩增,最后,将这支抗癌大军顺利回输到患者体内以发挥作用。
目前,这种方法已被批准治疗白血病和淋巴瘤,并导致多达三分之一没有其他治疗选择的患者进入长期完全缓解期。对此,伦敦帝国学院血液学中心的Karadimitris教授解释说,这意味着我们可以为患者提供一种很有希望的治疗方法,而不仅仅是与患者谈论临终关怀。
CAR19-iNKT细胞疗法
以上我们提及的CAR疗法是基于T细胞重编程的,然而,在这项新研究中,伦敦帝国学院的科学家使用的确实一种不同类型的免疫细胞—iNKT。
尽管这些细胞在体内非常罕见,但研究人员发现:相比较于CAR-T细胞,CAR19-iNKT在消除癌细胞方面要更有效。在小鼠淋巴瘤模型中,接受CAR19-iNKT细胞治疗的90%的小鼠获得了长期存活,而接受CAR-T治疗的小鼠存活率仅为60%。
而同时靶向CD19和CD1d可能会诱导更深入的抗肿瘤反应,限制与CAR靶标丢失相关的免疫逃逸,并最终减少疾病复发。早期肿瘤负荷最高的小鼠在接受免疫疗法处理后随后复发,接受CAR19-iNKT治疗后,其中四只小鼠中都观察到了第二次缓解,进一步突出了早期深度缓解的重要性。
此外,研究人员惊讶地发现CAR19-iNKT细胞还能够到达脑部,并且还可以对付大肿瘤。这意味着有朝一日,该技术用于治疗脑肿瘤以及其他癌症如前列腺和卵巢癌的可能性。
值得期待的抗癌选择
Bloodwise的血液癌症研究主任Alasdair Rankin博士说:“目前英国国家健康系统NHS引进的CAR-T药物对大量患者有效,但并不是每个人,而且治疗费用相当昂贵。”
“虽然相比较来说,CAR19-iNKT的研究尚处于早期阶段,但它描绘了这种治疗方法的未来前景。廉价、可大规模生产、高效的抗肿瘤活性都值得期待。如果成功,它将为更多患者带来挽救生命的治疗方法。”
该研究的第一作者Antonia Rotolo博士解释说:“目前CAR-T细胞的生产需要使用患者自己的T细胞。但iNKT细胞可以来自健康个体,并且其与T细胞不同,不需要与患者匹配。这意味着CAR19-iNKT细胞治疗可以实现现货治疗,即off the shelf。
另外,她还补充说,该技术的下一步是在患者身上进行测试。虽然其团队在动物实验中已经证明了该方法可以消除癌细胞,但无法预测潜在的副作用。因此,研究人员将通过患者试验对此进行研究。
目前,英国皇家创新公司(Imperial Innovations)作为伦敦帝国学院的技术商业化合作伙伴,已经为基础细胞处理技术申请了专利,并与Karadimitris教授合作开展商业应用。


{replyUser1} 回复 {replyUser2}:{content}