攻克KRAS之后,这位先驱有望突破p53“不可成药性”
KRAS和TP53是癌症中常出现基因突变的两个基因,虽然它们在癌症发生中的重要作用早已经被证实,然而靶向它们的新药开发却面对重重阻碍。加州大学旧金山分校(UCSF)的Kevan M. Shokat教授实验室已经在靶向KRAS领域深耕多年,他们于2013年在《自然》上发表的论文描述了将KRAS G12C突变体“锁死”在失活构象的“口袋”,为特异性抑制KRAS G12C突变体的活性提供了潜在靶标。这一科学突破最终带来了FDA批准的KRAS G12C特异性抑制剂Lumakras。
近日,Shokat教授团队发表论文,显示利用靶向KRAS G12C的思路开发的小分子共价化合物能够与p53 Y220C突变体结合,恢复其热稳定性达到和野生型p53相当的程度。这一突破性研究有望打开靶向p53这一历史上“不可成药”靶点的大门。Shokat教授联合创建的Nested Therapeutics公司也在已经获得1.25亿美元助力,并获得了其实验室靶向p53 Y220C突变体的一系列化合物的开发权益,将进一步进行新药开发。

p53被誉为“人体基因组的守护者 ”,它是一种调控转录的DNA结合蛋白,p53每天都会不停地监测人体的细胞,以保证它们在生长和分裂的过程中不出现错误。如果细胞在DNA复制过程中出现错误,p53可以在细胞分裂前修复它们。如果出现的错误无法被修复,p53能够引发细胞周期停滞或者细胞死亡。另一方面,当致癌基因异常表达时,p53能够阻止细胞增殖。当编码p53的TP53基因出现突变,导致p53失活或缺失时,会导致细胞中的基因突变数目增多,从而促进癌症的发生和发展。
与通常的小分子抑制剂不同,靶向p53的小分子药物需要恢复p53失去的功能而不是抑制p53的正常功能。这给药物研发增添了难度,而且p53蛋白的表面光滑,没有合适的口袋能够与化合物结合,因此成药方面的挑战也不容忽视。
p53 Y220C突变是一种发生在p53的DNA结合域的常见突变,这一突变导致p53的DNA结合域的热稳定性降低,携带这一突变的p53难以维持稳定的DNA结合域构象,因此导致与DNA的结合能力下降,无法完成应有的DNA调控功能。

▲p53 Y220C突变体的DNA结合域稳定性降低(图片来源:PMV Pharma公司官网)
此前的结构学研究发现,p53 Y220C突变体中存在一个可以与药物结合的口袋。由于这一突变体提供了可以与共价药物结合的半胱氨酸(C),Shokat教授的团队着手沿用靶向KRAS G12C突变体的策略,开发能够与p53 Y220C突变体结合的共价药物,旨在恢复p53的热稳定性。
根据p53 Y220C突变体的结构,并且借鉴了以往与这一突变体结合的化合物的特征,研究人员开发了一系列化合物(KG1~KG13)。最终优化的候选化合物KG13在体外实验中能够将p53 Y220C突变体的热稳定性恢复到和野生型一样的程度。同样重要的是,这一小分子化合物只会与p53 Y220C突变体结合,而不会与野生型的p53结合。而且它与p53 Y220C突变体的结合并没有改变p53与DNA结合的特异性。
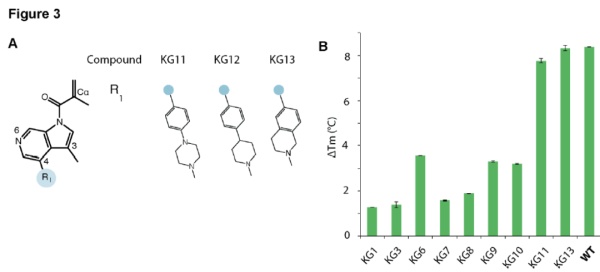
▲KG13将p53 Y220C突变体的热稳定性恢复到和野生型一样的程度(图片来源:参考资料[1])
为了检验KG13能否具有治疗潜力,研究人员在三种不同源于患者的肿瘤细胞系中检验了KG13的作用。名为NUGC-4的细胞系携带两个TP53的野生型拷贝;NUGC-3携带一个野生型TP53等位基因和一个编码p53 Y220C突变体的等位基因,BxPC-3携带一个编码p53 Y220C突变体的等位基因,另一个等位基因不表达p53。实验结果显示,KG13剂量依赖性降低这些肿瘤细胞系的存活率,对携带p53 Y220C突变体的细胞系的作用更为明显。而且,KG13在携带p53 Y220C突变体的细胞系中显著提高介导细胞死亡的caspase 3/7的活性。
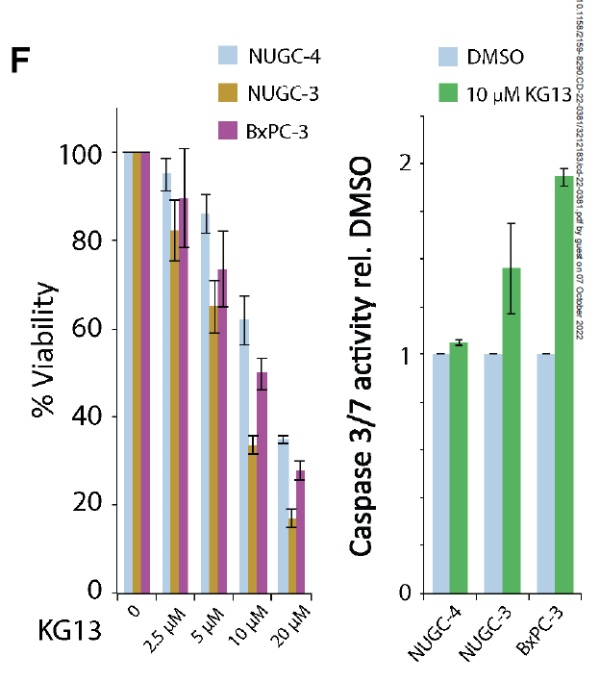
▲KG13降低携带p53 Y220C突变体的肿瘤细胞的存活率,并且提高caspase 3/7活性(图片来源:参考资料[1])
研究人员在论文中指出,这是首款将p53 Y220C突变体的热稳定性提高到和野生型一样的共价小分子p53靶向疗法。而且其结构学分析显示,p53的DNA接合域的新构象可能为靶向疗法提供可结合的口袋。这一研究和开发的化合物,有望为每年超过125000名携带p53 Y220C突变体的患者提供创新治疗策略。

日前,Shokat教授联合创建的Nested Therapeutics公司宣布完成9000万美元的A轮融资,致力于推动精准抗癌疗法的开发。论文披露,Nested Therapeutics公司已经获得了论文中介绍的KG化合物系列的开发权益。期待在资本的助力下,这一突破性研究能够完成转化,早日带来攻克p53不可成药性的靶向疗法。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}