重磅流感新药有望今年获批 口服一次 长期有效!
今日,罗氏 (Roche) 集团旗下的基因泰克 (Genentech) 公司宣布,美国 FDA 接受了该公司为抗流感新药 baloxavir marboxil 递交的新药上市申请 (New Drug Application, NDA),并且授予其优先审评资格(priority review)。Baloxavir marboxil 是一种具有创新抗流感病毒机制的“first-in-class”、只需口服一次就能起效的抗流感药物。它将用于治疗 12 岁以上的无并发症的急性流感患者。美国 FDA 预计在 2018 年 12 月 24 日前完成对该药物的审评,为流感患者献上一份特别的圣诞礼物。
流行性感冒 (influenza) 简称流感,对全球人类的健康是一个严重威胁。每年流感的流行导致大约 300-500 万患者病情严重,上百万患者需要住院接受治疗,多达 65 万人因此去世。
目前对流感的防治方法包括流感疫苗和诸如奥司他韦 (oseltamivir) 一类的抗病毒药物。但是流感疫苗并不能对所有的流感病毒产生防护效果,而奥司他韦需要患者每日服用 2 次,并且持续服用 5 天,而且已经有感冒病毒对它产生抗性。
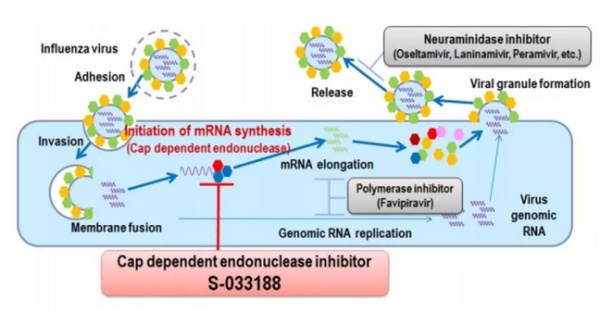
Baloxavir marboxil 是最初由日本塩野义制药 (Shionogi& Co) 开发的抗病毒新药,它通过抑制流感病毒中的 cap- 依赖型核酸内切酶 (cap-dependent endonuclease) 起到抑制病毒复制的作用。已有抗流感药物的作用机制都是通过靶向神经氨酸酶 (neuraminidase) 来防止病毒在体内传播。与这些药物相比,baloxavir marboxil 靶向病毒复制周期的更早阶段,而且它能够对已经对奥司他韦产生抗性的流感病毒产生疗效。
▲这款新药的作用机理(图片来源:Shionogi 官方网站)
在名为 CAPSTONE- 1 的含安慰剂对照,多中心随机双盲临床 3 期试验中,在美国和日本的 1436 名流感患者接受了 baloxavir marboxil 或安慰剂的治疗。试验结果表明 baloxavir marboxil 达到了试验的主要终点和次要终点。与安慰剂相比,它能够将流感症状的持续时间减少 26.5 个小时 (53.7 小时比 80.2 小时,p<0.0001),将发烧的持续时间减少接近一天(24.5 小时比 42.0 小时,p<0.0001)。
与奥司他韦相比,baloxavir marboxil 在减弱流感症状方面的效果相同,但是一个显著的区别是它能够更早地防止病毒从患者身体中的释放。服用 baloxavir marboxil 的患者的平均病毒脱落期 (viral shedding) 为 24 小时,而服用奥司他韦的患者的病毒脱落期为 72 小时 (p<0.0001)。这一区别对限制病毒的传播非常关键。
在安全性方面,baloxavir marboxil 表现出良好的安全性和耐受性,患者中出现的副作用小于安慰剂组和奥司他韦组。
“近年来流感季节的严重性表明我们需要除了现有疗法以外的创新治疗选择。如果获得批准,baloxavir marboxil 将成为近 20 年来第一例具备创新作用机制的抗流感药物,”罗氏的首席医学官兼全球产品研发负责人 Sandra Horning 博士说:“在临床试验中,baloxavir marboxil 只需服用一次,就能显著减少流感症状的持续时间,并且在一天后就能够显著减少病毒脱落。我们期待在审评过程中与 FDA 继续合作。”
目前正在进行的临床 3 期试验将检验 baloxavir marboxil 在治疗儿童流感患者时的安全性和疗效。治疗 12 岁以上,有高风险出现流感并发症人群的临床 3 期试验结果将在晚些时候公布。
参考资料:
[1] FDA Grants Priority Review to Genentech's Baloxavir Marboxil for the Treatment of Influenza
[2] Baloxavir Marboxil 官方介绍
[3] New, fast-acting flu drug gets priority FDA review
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。



{replyUser1} 回复 {replyUser2}:{content}