中科院植物分子遗传实验室:四篇高水平文章揭示植物生命奥秘
自从去年12月以来,中科院分子植物卓越中心/植物生理生态研究所植物逆境生物学研究中心植物分子遗传国家重点实验室杜嘉木课题组就连续发表4篇高水平的文章,可谓是丰收之年!它们分别是:
2018年8月27日,PNAS杂志在线发表了中科院分子植物卓越中心/植物生理生态研究所植物逆境生物学研究中心植物分子遗传国家重点实验室杜嘉木课题组和美国加州大学洛杉矶分校Steven Jacobsen课题组合作完成的题为“Mechanistic insightsinto plant SUVH family H3K9 methyltransferases and their binding to context-biasednon-CG DNA methylation”的研究论文。该论文从结构生物学、生物化学、基因组学等层面多角度的对植物特有的SUVH家族组蛋白H3K9甲基化酶开展了研究,发现了这类酶的调控机制,并成功解析了植物CHG位点甲基化序列偏好性的分子基础。
2018年8月6日,中国科学院分子植物卓越中心植物逆境生物学研究中心植物分子遗传国家重点实验室杜嘉木课题组与美国威斯康辛大学钟雪花课题组合作完成以“EBS is a bivalent histone reader that regulates floral phase transition in Arabidopsis”为题的论文,在线发表在国际核心学术期刊Nature Genetics上。该研究综合利用结构生物学、生物化学、细胞生物学以及植物分子遗传学等多种研究手段相结合的方式,全面揭示了二价组蛋白阅读器EBS在拟南芥花期调控中的作用机制;
2018年6月21日,Nature Communications杂志在线发表了中科院分子植物卓越中心植物逆境生物学研究中心植物分子遗传国家重点实验室杜嘉木课题组和威斯康辛大学麦迪逊分校钟雪花研究组合作完成的题为“Dual recognition of H3K4me3 and H3K27me3 by a plant histone reader SHL ”的研究论文,该研究综合利用结构生物学、生物化学、植物分子遗传学和基因组学等手段联合揭示了植物特有的组蛋白识别蛋白SHL通过自身BAH结构域和PHD结构域分别识别抑制性组蛋白修饰H3K27me3和活性组蛋白修饰H3K4me3的分子机制;
2017年12月12日,The Plant Cell杂志在线发表了我们组(中科院上海生科院植物逆境中心杜嘉木课题组)和中科院遗传发育所曹晓风院士课题组合作完成的题为“Structure of the Arabidopsis JMJ14-H3K4me3 ComplexProvides Insight into the Substrate Specificity of KDM5 Subfamily Histone Demethylases”的研究论文,该研究是利用结构生物学,生物化学和细胞生物学等手段揭示了KDM5亚家族组蛋白去甲基化酶的底物识别机制。
1、PNAS:逆境中心杜嘉木研究组与美国加州大学洛杉矶分校Steven Jacobsen课题组合作发现了植物特有的SUVH家族甲基化酶的调控和体内序列偏好性的分子机制!

DNA甲基化是一类重要的表观遗传标记,对维持基因组的稳定性有着重要的意义。植物DNA甲基化严格受到组蛋白修饰H3K9me2的调控。植物中H3K9的甲基化主要由植物特有的SUVH家族蛋白来完成,通过其SRA结构域结合甲基化的DNA,并通过其SET结构域来进行组蛋白甲基化。然而这类酶的生化调控机制却研究很少。
该研究中,研究人员首先对SUVH家族成员SUVH6开展了结构生物学研究,测定了SUVH6与甲基化的DNA、辅因子SAM等不同组合的多个状态的复合物的晶体结构。通过结构分析,发现SUVH6的肽底物结合通道受到自身的自抑制调控。并且,SUVH家族的蛋白结合甲基化DNA更依赖于其thumb loop,而不同于哺乳动物的UHRF1更依赖于NKR finger。在此基础上,研究人员测定了SUVH4/5/6三个同源冗余基因和不同序列的甲基化DNA的结合常数,发现植物中负责H3K9甲基化的主效基因SUVH4更加偏好CAG/CTG甲基化,SUVH5更偏好CCG甲基化,SUVH6则没有偏好性,成功的解释了拟南芥中CAG/CTG甲基化明显高于CCG甲基化的原因。合作方的全基因组Chip-seq实验也验证了这个解释。本项研究大大加深了人们对SUVH家族甲基化酶的调控和体内序列偏好性的认识。
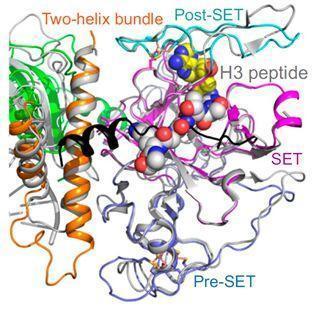
SUVH6受到自抑制调控
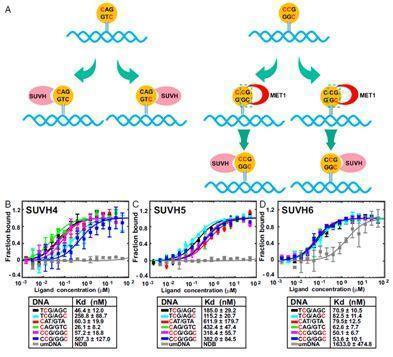
不同SUVH家族成员有不同的序列偏好性
逆境中心研究生李雪琴是该论文的共同第一作者,杜嘉木研究员和Steven Jacobsen教授是该论文的共同通讯作者。该研究工作受到了科技部国家重点研发计划,基金委,植物分子遗传国家重点实验室,以及中科院的经费资助。
2、Nature Genetic:逆境中心杜嘉木研究组与威斯康辛大学麦迪逊分校钟雪花研究组合作揭示EBS调控植物开花的分子机制

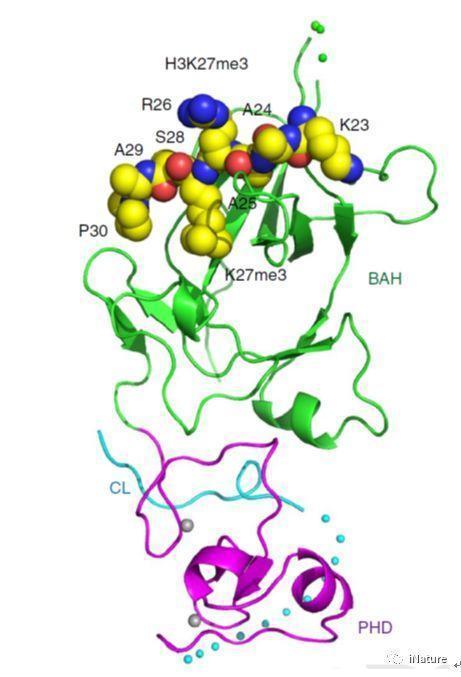
组蛋白修饰属于表观遗传学范畴,它与生命体的生老病死过程息息相关。其中赖氨酸甲基化修饰作为一种重要而广泛的修饰方式而被深入的研究,不同组蛋白位点的赖氨酸甲基化有着不同的生理功能,其中组蛋白H3K4me3修饰表征着基因的活化信号,而与之相反的是H3K27me3则表征着基因的抑制信号。研究人员在研究中发现拟南芥EBS包含有两个结构域,一个是BAH结构域另一个是PHD结构域,而这两个结构域通常都是组蛋白标记的识别因子。其中PHD结构域的功能是结合H3K4me3,BAH结构域的功能则并不清楚。
图一
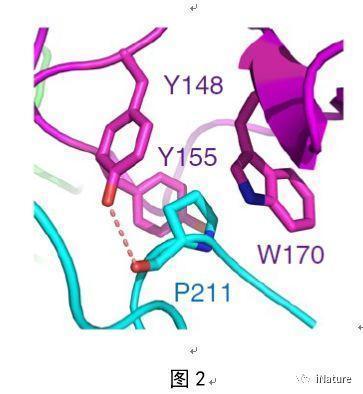
在该项工作中,研究人员首先通过体外实验证实EBS可以结合基因激活的组蛋白标记H3K4me3,有意思的是同时也发现EBS还可以结合与之相反的基因抑制的组蛋白标记H3K27me3,且结合H3K27me3的亲和力要高于结合H3K4me3的亲和力。进一步的结构生物学研究发现EBS的BAH结构域通过识别肽段H3K27me3的甲基化赖氨酸和第30位的脯氨酸来实现序列选择的特异性(图1)。令人感兴趣的是,EBS可以通过C端一段含有脯氨酸的无规则结构以自抑制的方式抑制PHD结构域结合H3K4me3(图2)。当删除C端的自抑制结构后,EBS结合H3K4me3的亲和力将高于结合H3K27me3的亲和力。
体内的实验也表明,EBS在染色质上也可以结合H3K4me3和H3K27me3,且与H3K27的甲基化酶CLF在基因组上的分布相似,EBS在基因体靠近转录起始位点附近的丰度较高。不论是破坏了EBS参与识别组蛋白H3K4me3的还是H3K27me3的关键氨基酸,甚至删除自抑制结构后,,突变体不能回补ebs早花的表型。因此,证明了EBS作为一个分子开关,需要通过识别两个功能相反的组蛋白修饰标记以及准确的转变其结合偏好性来确保开花时间的准确性。
在该项研究中,中国科学院植物逆境生物学研究中心杜嘉木课题组完成了结构以及生化部分的工作,美国威斯康辛大学钟雪花课题组完成了遗传和基因组方面的工作。逆境中心杨振林同学是该轮文的共同第一作者,逆境中心杜嘉木研究员及威斯康辛大学麦迪逊分校钟雪花博士为共同通讯作者。该项研究的完成受到科技部国家重点研发计划,自然科学基金委以及中科院的经费资助。上海同步辐射光源国家蛋白质设施为晶体衍射数据的收集和处理提供帮助。威斯康辛大学生物技术中心协助完成了高通量测序工作。
原文链接:EBS is a bivalent histone reader that regulates floral phase transition in Arabidopsis
3、Nature Communications:逆境中心杜嘉木研究组与威斯康辛大学麦迪逊分校钟雪花研究组合作揭示SHL蛋白对于抑制和活性组蛋白修饰的识别机制

组蛋白的转录后修饰作为表观遗传中重要的调控机制之一,在包括基因表达调控等多种生物学过程中起着重要作用。组蛋白修饰的识别因子具有对于不同的组蛋白修饰特异性识别的能力,并进而在染色体的状态调控中起到重要作用。通常识别蛋白含有多个组蛋白识别结构域,这些结构域通常以串联的方式存在,并且在多价染色质结合中起作用。
拟南芥SHORT LIFE (SHL)同时具有两个潜在的组蛋白识别因子:BAH 及PHD 结构域,在拟南芥的开花及种子休眠起到重要调控作用。在之前报道中表明SHL可以通过抑制开花过程中整合因子SUPPRESSION OF OVEREXPRESSION OF CO1 (SOC1) 的表达进而抑制开花。尽管SHL蛋白起到了抑制开花的作用,其具体的分子机制还不是很清楚。
在本研究中,研究人员首先通过组蛋白肽段微阵列芯片技术发现SHL蛋白可以识别组蛋白激活修饰H3K4me3 及组蛋白抑制修饰H3K27me3,通过ITC 证实SHL可以识别甲基化的H3K4和H3K27。紧接着,研究人员利用X射线晶体衍射的方法分别解析了SHL与H3K4me3及H3K27me3的复合物结构,并结合其他生化实验证实证明了SHL能够分别通过其PHD和BAH域独立识别活性组蛋白标记H3K4me3和抑制标记H3K27me3。通过Chip-seq实验证实SHL在体内分布与共富集H3K4me3和H3K27me3的区域相关。遗传实验证明SHL蛋白中的BAH-H3K27me3和PHD-H3K4me3结合位点突变会导致不能回补早期shl突变体开花表型,表明SHL与H3K27me3和H3K4me3的结合在体内是具有重要功能。
逆境中心二年级研究生吕莘辰同学是该轮文共同第一作者,逆境中心杜嘉木研究员及威斯康辛大学麦迪逊分校钟雪花博士为共同通讯作者。上海同步辐射光源国家蛋白质设施BL19U1(SSRF)为数据收集提供了及时有效的支持。该研究工作得到了科技部国家重点研发计划,国家自然科学基金委,以及中科院相关经费的大力资助。
原文链接:Dual recognition of H3K4me3 and H3K27me3 by a plant histone reader SHL
4、The Plant Cell:一作讲坛,组蛋白去甲基化酶作用机制新思路探讨

组蛋白甲基化可以影响众多的生物学过程,如衰老及癌症等方面。但是组蛋白甲基化也受组蛋白甲基转移酶和组蛋白去甲基化酶的调节。含有jumonji结构域的组蛋白去甲基化酶具有不同的功能,可分为几个亚家族。在人类中,含有jumonji结构域和ARID结构域蛋白(KDM5 / JARID)亚家族去甲基酶对于H3K4me3是特异性的,并且是癌症治疗的重要药物靶标。在拟南芥中,KDM5 / JARID亚家族H3K4me3去甲基酶JUMONJI 14(JMJ14)在开花,基因沉默和DNA甲基化中起重要作用。
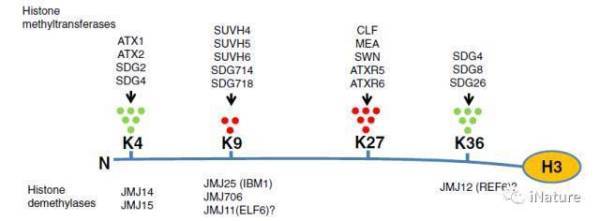
JMJ蛋白家族功能简单总结,来源Chen,et al(Review)
先前的研究表明拟南芥JMJ14是一个含有jumonji结构域的组蛋白 H3K4me3的去甲基化酶,从序列分析上属于KDM5亚家族。人源的KDM5亚家族基因可以促进肿瘤生成及产生耐药性,因而是重要的抗癌药物靶标,但是不管是植物还是动物中KDM5亚家族去甲基化酶的其底物识别机制一直不是很清楚。拟南芥的JMJ14已报道具有调控开花、RNA介导的基因沉默以及DNA甲基化等重要的生理过程,但是其底物识别机制也不是很清楚。在该研究中,我们使用了更为精准的酶活测定系统,质谱结果表明JMJ14是一个H3K4me3和me2的去甲基化酶,而对me1作用不明显。而后利用X射线晶体衍射的方法解析了JMJ14处于apo状态和底物复合物状态的结构。
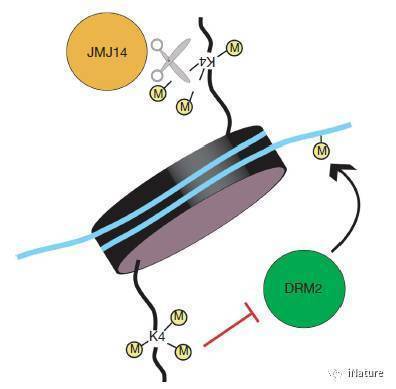
JMJ14可能的作用机制,来源Deleris,et al
JMJ14主要有jumonji、helical以及C5HC2三个结构域组成,其中jumonji以及C5HC2结构域上的3个酸性氨基酸与组蛋白小肽上H3R2和H3Q5发生了大量的氢键以及盐键的相互作用,形成特异性识别。将这几个酸性氨基酸突变之后,JMJ14的体内酶活显著下降,表明这几个氨基酸确实参与了底物识别。此外,由于人源KDM5家族蛋白是一个重要的抗癌药物靶标,而其底物识别机制还不是很清楚。通过氨基酸序列和三维结构比对发现,JMJ14参与底物识别的氨基酸在KDM5B中也非常保守,暗示这它们采用了相似的底物识别机制。之后将KDM5B中相应的氨基酸突变后其酶活明显下降,证明了以上猜想。该项工作不仅解析了以JMJ14为代表的KDM5亚家族H3K4me3去甲基化酶的去甲基化机制,还为以人源KDM5为靶标的抗癌药物开发提供了理论基础。
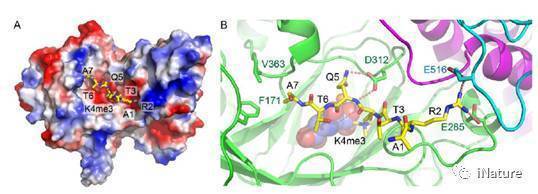
JMJ14特异识别并催化组蛋白H3K4me3的分子机制
这篇文章是我们和遗传发育所曹晓风院士共同合作完成。同时普渡大学的陶纬国教授,中科院上海生化细胞所的陈德桂研究员及南方科技大学的李思思副教授为该论文提供了重要的支持和帮助。遗传发育所邱琦博士和逆境中心陈小梅博士等参与了课题的相关部分。逆境中心质谱平台为本研究提供了酶活实验帮助。上海同步辐射光源国家蛋白质设施BL19U1(SSRF)为数据收集提供了及时有效的支持。该研究工作得到了科技部国家重点研发计划,国家自然科学基金委,以及中科院相关经费的大力资助。
来源:iNature
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}