改写教科书!科学家重新确定抗体IgM结构
在一项新的研究中,来自日本东京大学的研究人员通过利用计算机图像分析和现代的电子显微镜成像揭示了一种至关重要的称为免疫球蛋白M(IgM)的免疫蛋白的结构,从而为未来开发出针对从癌症到神经系统疾病的一系列疾病的更加有效的药物提供了可能性。相关研究结果发表在2018年10月10日的Science Advances期刊上,论文标题为“The IgM pentamer is an asymmetric pentagon with an open groove that binds the AIM protein”。论文通信作者为东京大学的Toru Miyazaki和Satoko Arai。
图片来自Science Advances, doi:10.1126/sciadv.aau1199。
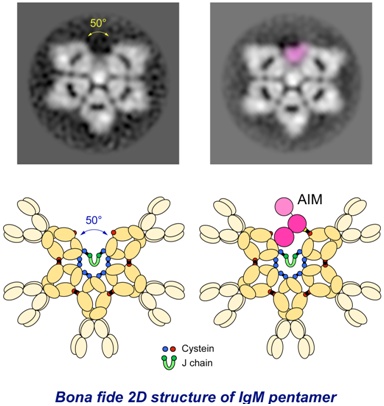
IgM是免疫系统的一个重要的组成部分。这些研究人员利用IgM的人类版本和小鼠版本对天然的IgM的结构进行了验证。他们认为IgM如今应当被理解为形状像不完整的六边形,或者像是有楔形缺口的五边形。Miyazaki说,“我们将不得不改写教科书。”
IgM是首个在人类胎儿中产生的免疫系统蛋白,并且在一生当中始终首先对病原体入侵作出反应的蛋白分子。 IgM的结构于1969年首次被确定为“五角星形状的桌子(five-pointed, star-shaped table)”,并于2009年更新为五面圆顶(five-sided dome)或“蘑菇形帽(mushroom cap)”。
Miyazaki说,“最初的IgM结构模型是通过低分辨率的显微镜观察几个IgM分子构建出来的。如今,我们有了更清晰的图片,而且计算机能够研究成千上万个IgM分子。”当Miyazaki当初还是一名医学博士时,他的研究生涯就研究了一种不同的称为巨噬细胞凋亡抑制因子(apoptosis inhibitor of macrophage, AIM)的蛋白。
由于确定了IgM的正确形状,这些研究人员如今了解到没有活性的AIM位于IgM的不完整六边形的空隙内。IgM和AIM之间的结构关联性意味着具有调节AIM释放能力的药物可能被用来开发基于AIM的疾病治疗方法。当其他的分子激活免疫系统时,IgM会释放AIM。尺寸较小的AIM蛋白在体内循环,以便清除受损的细胞和阻止疾病产生。
1999年,Miyazaki在瑞士巴塞尔免疫学研究所工作时就已鉴定出AIM。它的小尺寸意味着AIM很容易通过肾脏从体内排出并进入尿液中,因此与较大的IgM结合在一起可保护AIM在需要之前不被清除。
AIM是血液中的一种常见的分子,但是它仅在身体发病时才是有活性的。已知AIM在预防肥胖、脂肪肝疾病、肝细胞癌、多发性硬化症、真菌诱导性腹膜炎和急性肾损伤中起着重要的作用。
这种不完整的六边形结构仍然只是对IgM结构的二维理解。Miyazaki和他的团队继续开展进一步的分析,并希望尽快地报道IgM的三维结构。
相关论文:
E. Hiramoto, A. Tsutsumi, R. Suzuki et al. The IgM pentamer is an asymmetric pentagon with an open groove that binds the AIM protein. Science Advances 4: eaau1199 (2018), doi:10.1126/sciadv.aau1199.
A. FEINSTEIN et al. Conformation of the Free and Antigen-bound IgM Antibody Molecules, Nature (2006). DOI: 10.1038/2241307a0
D. M. Czajkowsky et al. The human IgM pentamer is a mushroom-shaped molecule with a flexural bias, Proceedings of the National Academy of Sciences (2009). DOI: 10.1073/pnas.0903805106
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}