欣喜与质疑背后 从Aduhelm到GV-971 如何看待阿尔茨海默病的治疗未来?
在铺天盖地的鼓舞声中,在此起彼伏的争议声中,人类抗击阿尔茨海默病的征程终于又向前迈进了一大步。
美国时间6月7日,FDA加速审批渤健生物单抗药物Aduhelm上市,用于治疗早期阿尔茨海默病(AD)。
这是自2003年以来,FDA批准的首款AD新药,同时也是阿尔茨海默病被命名100多年来,FDA首个批准的疾病修正类药物。
人们欣喜的地方在于,在这个千帆折戟的医学领域,终于看见了新的曙光。同时伴随着FDA对于AD药物更加务实和灵活的态度,未来更多在研或已经降至“冰点”的AD药物有望进一步找到生机,加速全球获批征程,更快走近患者。
而争议的焦点在于,此前由于Aduhelm曾因临床试验的不完整性及两个III期试验结果相互矛盾,被FDA咨询委员会几乎一致否定。如今突然反转获批,科学界对这样史无前例的”危险操作”感到无比震惊和失望,甚至有3位FDA咨询委员会专家接连辞职,以示抗议。
此外,Aduhelm备受质疑的地方还在于:其背后的作用机理“Aβ”假说本身用于治疗阿尔茨海默病的证据还不充分。
这样的惊喜和质疑似乎来得似曾相识,两年前,GV-971在国内有条件获批上市时,同样面临着关于其临床试验以及作用机理的诸多争议。
对此,一位长期从事阿尔茨海默病研究的业内人士向新浪医药表示:“不管是Aduhelm还是GV-971,证据不充分都提醒着我们不要盲目乐观,但同时也提醒着我们不要着急否定。一切结论有待进一步更充分的证据来证明。”
而两款AD治疗药物先后在国内、国际获批带来的巨大惊喜与争议背后,我们更应该冷静地探讨其对患者现实之需的意义:
从GV-971、Aduhelm的作用机理来看,人类何时能找到真正对抗阿尔茨海默病的新武器?
借Aduhelm破例获批东风,国产GV-971离进一步全球上市的道路还有多长?
远在大洋彼岸获批的Aduhelm,离惠及中国患者还有多远?
当然,还有最重要的是,它们分别卖多少钱?患者药物可及性如何?
……
01 对抗阿尔茨海默病,对因治疗或成真正武器?
重压之下,FDA和CDE顶住压力分别批准Aduhelm、GV-971两款AD治疗药物有条件上市,最大的原因应该是:一直在黑暗里徘徊的阿尔茨海默病留给我们的时间不多了。
数据显示,目前全球阿尔茨海默病有患者超过5000万,预计2030年时,患者将超过7400万;2050年,患者总数将达到1.5亿。其中我国目前有1000万阿尔茨海默病患者,数量已居全球之首,预计到2050年还可能爆发至4000万人!照这个趋势下去,势必将给越来越多的患者还有其家庭、社会带来巨大的痛苦和负担。
而与形势严峻相衬托的是现实惨淡。
对于临床研究而言,阿尔茨海默病是人类医学领域中的一个“绝对死角”,是新药研发的重灾区——临床失败率高达99.6%,艰辛程度可谓远胜登月。
据悉,1998年-2017年间, 全球共有146个阿尔茨海默病药物在临床研发中心遭遇失败。在Aduhelm之前,FDA仅批准过6种阿尔茨海默病治疗药物,分别为:
①1993年批准的他克林(已退市);
②1996年批准的多奈哌齐;
③2000年批准的卡巴拉汀;
④2001年批准的加兰他敏;
⑤2003年批准的盐酸美金刚;
⑥2014年批准的美金刚/多奈哌齐复方制剂。
但这些药物都只能改善患者的症状,不能减轻AD的病理变化,也不能逆转或减缓疾病进程。
而Aduhelm、GV-971两款AD治疗药物之所以备受关注,又深陷争议风暴,就在于它们是针对阿尔茨海默病基本病理,是对因治疗(疾病修饰)的药物,研究基础来源于假说理论。
由于阿尔茨海默病的发病原因和机制至今尚未明确,目前药物研发都是基于各种假说理论,包括大脑β-淀粉样蛋白(Aβ)沉积、神经纤维缠结、神经炎症(脑-肠轴)等。
◆ 渤健的Aduhelm——靶向Aβ
“β-淀粉样蛋白异常沉积”是解释阿尔茨海默病最为广泛的假说,渤健的Aduhelm的研发正是基于该假说。Aduhelm是一种单克隆抗体,可以有选择性地与β-淀粉样蛋白沉积结合,通过激发免疫反应,进而清除沉积的蛋白斑块。
目前,关于渤健Aduhelm最大的争议,一是其上市之路一波三折,不断反转,两项关键性临床试验结果自相矛盾遭质疑;另一个就是β-淀粉样蛋白假说本身,也充满着争议。
据悉,基于患者脑部β-淀粉样蛋白沉积的现象,研究者展开了大量研究,试图寻找治疗阿尔茨海默病的特效药物。然而,这些研究疗法虽然能够成功降低Aβ水平或消除大脑中β-淀粉样蛋白的沉积,但对患者认知能力的衰退却没有帮助。这些发现让β-淀粉样蛋白假说备受质疑。
据Aduhelm经临床研究显示,可以选择性结合β-淀粉样蛋白,从而清除阿尔茨海默病患者大脑中的β-淀粉样蛋白堆积,但清除β-淀粉样蛋白能否带来更佳的临床结果,还有待进一步的考证。
◆ GV-971——靶向脑-肠轴
GV-971由中科院上海药物研究所的耿美玉教授和绿谷制药共同研发,2019年11月在我国获CDE批准有条件上市。(严格意义上来讲,2019年GV-971获CDE批准有条件上市,应该是自2003年之后的全球范围内第一个获批上市的AD药物,目前该药正在进行国际多中心Ⅲ期临床研究,还在等待国际临床获批结果。)
传统阿尔茨海默病药物研究往往针对在大脑中逐渐累积成块的β-淀粉样蛋白,以及由Tau蛋白过度磷酸化引发的神经原纤维缠结。
GV-971是一款另辟蹊径的对因治疗药物,其作用靶点是脑-肠轴。
要理解靶向脑肠轴机制,首先需要理解肠道菌群与大脑中枢神经之间的关联。近年来研究表明,作为机体的重要组成部分,肠道菌群的作用不仅限于胃肠道,还对脑功能和行为起到了重大的影响。
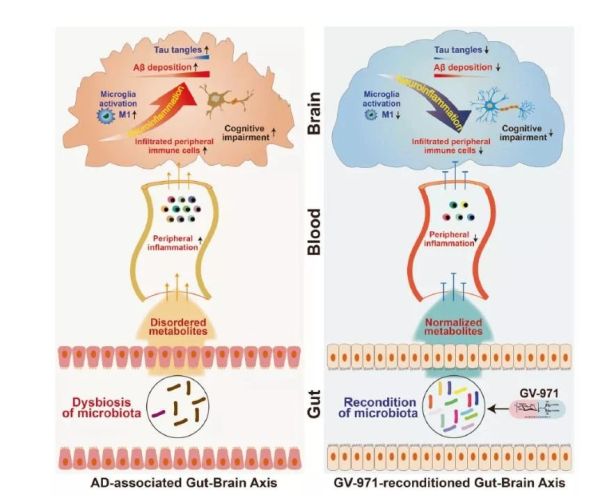
AD进程中的“脑-肠轴”致病模型及GV-971的治疗机理模型
耿美玉团队研究发现,肠道菌群的变化会引起苯丙氨酸和异亮氨酸在外周血内的积累,从而导致神经炎症的发生,最终产生认知功能障碍。
而GV-971作为以海洋褐藻提取物为原料、制备获得的低分子酸性寡糖化合物,可通过调节肠道菌群,减少菌群异常代谢产物,从而减轻脑内神经炎症。
此外,GV-971还能直接与Aβ结合,并减少Aβ在脑中的沉积。根据该药物在国内Ⅲ期临床研究主要疗效指标显示,GV-971可在36周的观察期内持续平稳地改善患者的认知功能,从基线到第36周,GV-971组在用药第4周后就与安慰剂组相比有显著差异,到试验结束的第36周时,两组的ADAS-cog12分差达到最大的-2.54分,整个试验期间两组之间的平均模型差异为-2.15分(95%CI [−3.07至−1.23])(见下图)。试验结果还证实,GV-971的安全性良好,不良事件发生率与安慰剂无显著差异。
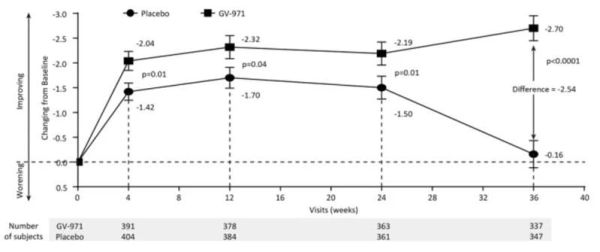
GV-971的三期临床主要指标ADAS-cog分值趋势图
作为一个近乎全新的AD致病机理,GV-971脑-肠轴中每一环间的因果性而非相关性的证明都至关重要而又困难重重。并且正是由于脑-肠轴是一个全新的AD致病机理,受到了许多质疑。
这些争议,同样都只能交给更多的时间、更充分的临床证据去验证。
02 两款有条件上市药物,同样任重而道远
尽管两款药物都受到争议,但毫无疑问,两者都已在各自领域取得成绩,率先抢跑,备受关注,而瞩目之下它们也都面临着更大的挑战与压力。
◆ Aduhelm的挑战
在FDA力排众议为渤健Aduhelm放行后,Aduhelm并非“高枕无忧”,仍有许多棘手问题悬在眼前——
退市风险:据悉,获批后,渤健需要进一步进行确证性试验确证药物的预期临床获益,否则可能会导致将该药从市场上撤销。
起效较慢且效果不明显:在ADUHELM的三期临床试验EMERGE中,高剂量ADUHELM™组与低剂量组的ADAS-cog13分值在0至50周时与安慰剂相比无显著差异,直到50周后,高剂量ADUHELM组才逐渐与安慰剂组拉开显著性差异,在78周时达到最大差异-1.4分,但这一差异与同类药物试验的有效性结果相比并不明显。在ADUHELM的另一项三期临床试验ENGAGE中,三组的ADAS-cog13分值从基线到第78周期间始终没有达到显著性差异(见下图)。
考虑到ADUHELM在两项临床研究中的有效性证据较弱,FDA在公告承认了该药物在临床试验中的有效性结果“喜忧参半”。
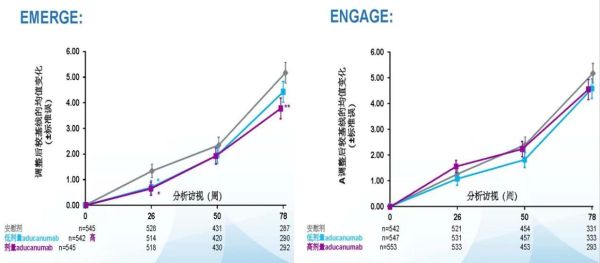
ADUHELM两项三期临床试验的ADAS-cog13分值趋势图
副作用危害:据华尔街见闻报道,从渤健公布的详细数据来看,接受高剂量 aducanumab 治疗的患者中,~35% 的患者出现 ARIA 相关的大脑水肿(ARIA-E),~18% 到 22.7% 的患者出现 ARIA 相关的微出血(ARIA-H)。这些潜在副作用,也引发科研界许多担忧甚至批判。
给药难以及费用高昂:据悉,患者接受Aduhelm治疗需要在医院静脉给药(约1小时)并配合监控,每四周输液一次,每次输液约4312美元,高剂量输液的成本约为5.6万美元/年,对于患者而言,这无疑是一笔比较高昂的治疗费用。
可以看到,Aduhelm虽然获FDA批准上市,但还远未站稳脚跟,因此对于中国患者翘首期盼地其何时能进入中国市场这个问题,有业内人士分析称,Aduhelm离惠及中国患者应该还有比较远的距离,主要原因在于:
Aduhelm目前还有很多关于自身的难题未解,需要应对,可能暂时无暇进击中国市场;
Aduhelm进入中国市场需要要求较高的临床试验设备(如pet等复杂的分析影像诊断,国内目前还没有相应上市的诊断产品等),以及严格的用药管理,这些具体操作的问题一时之间可能难以解决,增加了其进入中国市场的难度;
Aduhelm目前的年治疗费用约5.6万美金,约合人民币35.8万,如果按照这个价格进入中国市场,对于我国患者而言,将是一笔非常沉重的负担,药物可及性不高。
◆ GV-971的挑战
GV-971在我国有条件获批后,也面临着上市后需继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,并按时提交有关时间数据的监管压力。
同时,对于GV-971的信号作用通路和作用机理等诸多问题仍然备受关注。比如:
能够调控肠道的哪个细菌?
调控通道是什么?
作用位点是什么?
上市之后用于AD临床治疗是否达到满意结果?
是否发现新的副作用?
……
对于这些问题,目前,GV-971已经在我国上市超过1年半,许多答案渐渐浮出水面。一份从病人和医生角度做的调查回访显示:
73%的AD临床医生认为GV-971能够改善或保持阿尔茨海默病患者的认知症状;
63%的医生观察到GV-971可以改善神经行为症状;
47%的医生评价服用GV-971的AD患者日常生活能力有改善作用;
35%的医生认为GV-971患者语言能力、情绪、饮食、睡眠等有显著改善。
从这个数据上来看,GV-971在国内上市之后用于AD临床治疗效果是比较良好的,此外,从价格上来看,目前GV-971在国内的售价为是895元/盒,“36周治疗期”的费用为3.2万人民币左右。据悉该药在我国还有赠药援助项目,并且正在积极申请纳入医保,由此来看,我国患者或将可以以更经济的手段获得该药物。
此外,从药效来看,GV-971已经开始走出国门,接受全球检验:
2020年4月,FDA批准GV-971国际多中心Ⅲ期临床试验IND;
2020年11月,绿谷制药开始患者招募,目前已经实现首例患者用药;
2024年,GV-971计划完成临床阶段工作,2025年全球注册上市;
……
究竟GV-971国际多中心Ⅲ期临床试验将会展示怎样的临床效果?在Aduhelm上市后这个问题无疑将更受关注。
不过值得注意的的是,在基于在AD治疗领域巨大的社会压力和舆论诉求下,如今FDA破例为渤健Aduhelm放行的态度,既是为全球AD患者提供了崭新的希望,同时也是对未来研发AD药物的研究者们的一剂强心剂。
对此,有业内人士分析称,“FDA的态度势必会引起一些市场变化。此前因试验失败而导致药物上市失败的AD制药商或许会寻求其它‘替代终点’来重新寻求上市可能。而未来FDA是否会考虑放开,使用‘替代终点’作为药物审批上市的一个依据成为非常值得关注的一件事情。”
而对于已获FDA批准的国际多中心Ⅲ期临床试验IND的GV-971,未来能否借此东风加快全球上市征程,新浪医药将持续关注。
03 结语
我们习惯于用“九死一生”来形容一件事情的艰难,但在全球阿尔茨海默研究领域,99.6%的失败率早已超过“九死一生”的概率。多年来,无数科研工作者、制药商的信心被打击、被浇灭。有人将人类与阿尔茨海默病之间的战争,形容为一场彻彻底底的“远征”,好在,Aduhelm、GV-971的获批让我们看到在这条漫长而艰险的道路上终究有人走了下来,并带来了希望。
尽管争议滔天,但是不破不立,我们在期待全球医学界带来更多突破的同时,也呼吁大家在日常生活中要早预防、早干预,一旦确诊要坚持规范诊疗,共同抗拒阿尔茨海默病。
因为许多人把阿尔茨海默病当成衰老的一种现象,但事实上,阿尔茨海默病是一个致死性疾病,它是导致老年人死亡的第四大原因(仅次于心脏病、癌症和心脑血管意外),需要人们在日常生活中引起更多的重视。
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}