研发失败率99.6%,渤健Aduhelm之后,谁在努力撑起该领域的“下半场”!
此前,渤健、罗氏、强生、辉瑞、艾伯维等公司在AD新药研发上的纷纷折戟,无论是药企本身还是市场,都正在降低对该领域药物的成功预期。
·
·
·
在前行者已屡次碰壁的AD研发领域,药企的研发人员们依旧没有放弃。
在Aduhelm屡屡遇挫之后,渤健和卫材正积极开发第二款阿尔茨海默病药物lecanemab。就在前不久,渤健全球安全与监管科学部门的负责人,研发部门的临时负责人Priya Singhal在2022年渤健第二季度财报电话会议上透露了在研新药lecanemab的最新进展。FDA已同意Clarity AD完成后可作为验证lecanemab临床疗效的验证研究,在等待Clarity AD的研究结果之前,卫材计划在2023年第一季度在美国、欧盟和日本进行lecanemab的获批申请。如果lecanemab获批,它将成为第一个用于治疗阿尔茨海默病的抗淀粉样蛋白抗体。据悉,lecanemab是一种研究性抗β淀粉样蛋白(Aβ)原纤维抗体,可减少患者大脑中淀粉样蛋白斑块的积聚,用于治疗阿尔茨海默氏症引起的轻度认知障碍和轻度AD且确认大脑中存在淀粉样病变的患者。而坏消息则是,此前,渤健、罗氏、强生、辉瑞、艾伯维等公司在AD新药研发上的纷纷折戟,无论是药企本身还是市场,都正在降低对该领域药物的成功预期。这也是此次渤健二季报净利翻倍,市场却用暴跌回应的主要原因。同样,礼来在8月4日即将公布的二季度最新进展,也给市场留下悬念.如今,罗氏gantenerumab、礼来Donanemab、渤健lecanemab等多款阿尔兹海默症在研新药被行业寄予希望,在AD研发界接连遭遇挫折后,到底谁能够率先“冲出重围”?
不可否认,近年来AD研发虽有挫折,但也取得了重大进展。
去年Aduhelm的出现,标志着药物开发从对症干预转向针对AD的病理学。该药是由渤健和卫材合作研发,被FDA获得批准成为了自2003年以来首个用于阿尔茨海默病的新型疗法。Aduhelm的获批让大型制药企业看到了的实验疗法获得批准并在市场上站稳脚跟的可能性。可惜“出道即巅峰”,上市后的Aduhelm商业化之路并不理想,经历了种种挫折,推广效果甚微,之后在医疗保险和医疗补助服务中心(Centers for Medicare and Medicaid Services)的覆盖范围也受到了限制。据米内网全球药物研发库,阿尔兹海默症疾病领域目前涉及的机构共1388家,其中1126家尚处在药物发现阶段,占据最高比重;而能获得注册批件的则少之又少,仅为个位数。阿尔兹海默症新药在开发上的TOP5分别是辉瑞、罗氏、赛诺菲、默沙东、礼来,近期在行业内研发较火热的渤健和卫材则分别位于19位和10位。其中,辉瑞已上市的AD药品共5款,位于榜首,罗氏和礼来分别上市2款AD药物。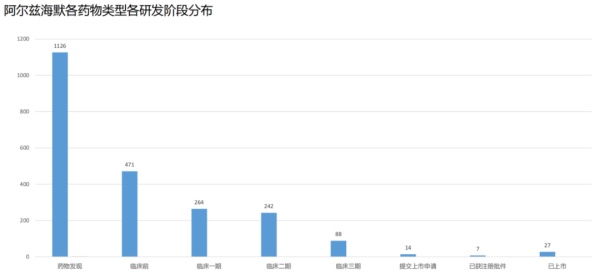 来源:米内网全球药物研发库
来源:米内网全球药物研发库
今年6月16日,罗氏与阿尔茨海默病研究所共同宣布,其研发的AD药物crenezumab对于常染色体显性阿尔茨海默病的二期临床失败。该临床试验在哥伦比亚招募了252名AD患者。其中约有2/3携带早老素1 E280A 基因突变,这一基因突变通常会导致患者在44岁左右出现阿尔茨海默病导致的认知障碍。这些患者在5到8年内接受了crenezumab或安慰剂治疗,最终有94%的患者完成了研究。遗憾的是,最终结果显示,在评估认知能力或情景记忆功能的变化率的两个主要目标中,均没有显示出具有统计学意义的临床益处。在那之后,另一家知名药企的AD药物研发也被迫放弃。艾伯维的合作伙伴Alector于去年11月份在阿尔茨海默病临床试验 (CTAD) 会议上报告了AL003的一期临床数据,数据表示AL003在轻中度阿尔兹海默病患者上有良好的安全性和疗效,艾伯维与Alector预计于2022年下半年开展二期临床试验。但最终却于6月30日,艾伯维发布通知,决定终止开发AL003。2022年AD药物研发多次遭遇挫折,让人清醒地意识到尽管在Aduhelm加速批准后的一年中,神经退行性疾病在药物开发领域依旧面临着残酷的局面。值得一提的是,失败的确让罗氏和渤健变得更谨慎,但却并没有没有拖累他们研发的脚步。目前,在罗氏的管线中还有另一款治疗AD的药物gantenerumab。FDA于去年授予Gantenerumab突破性疗法认定,然而继渤健AD新药遭受的一系列商业化挫折后,使得罗氏也变得有些迟疑。目前,罗氏正在评估gantenerumab在常染色体显性遗传阿尔茨海默病中的疗效。其在早期阿尔茨海默病中的Ⅲ期研究结果预计将于2022年第四季度公布。罗氏前首席执行官Severin Schwan在一次投资者电话会议上表示,gantenerumab是一个“高风险项目”,正在等待今年晚些时候公布第三阶段的关键数据。对于在研药物后期可能存在的结果,Severin Schwan称:“我们有无法通过获批的准备。当然,如果结果是积极的,那将是变革性的。”他强调,对于AD药物的开发会变得谨慎些。目前,渤健和卫材两家公司在研一款名为lecanemab的阿尔茨海默病后续治疗药物,系渤健和卫材联合研发的第二款阿尔茨海默病治疗药物。在本月,卫材和渤健宣布,美国FDA已授予在研药物lecanemab优先审评资格,处方药用户费用法案日期(PDUFA)日期为2023年1月6日。卫材表示,其与渤健合作开发的lecanemab是最重要的项目 ,将与阿尔茨海默病(AD)和相关脑健康疾病的疾病修饰疗法(DMT)相关的临床开发、监管、医疗、价值和获取、营销和联盟管理功能,在全球AD官员的领导下重组为阿尔茨海默病和大脑健康(ADBH)。Priya Singhal表示,卫材还在继续进行lecanemab第三期Clarity研究,预计将在2022年秋天公布结果。即将到来的第三阶段Clarity AD研究的设计基于之前2期研究的结果,采用临床平衡评估,以评估认知和功能的各个方面。鉴于试验设计的可靠性,Clarity AD的试验结果应该会使我们进一步了解淀粉样蛋白清除对阿尔茨海默病不同临床领域的影响。根据渤健的aduhelm开创的先例来看,医疗补助和医疗保险服务中心只为参与在阿尔茨海默病加速疗法下获得批准的单克隆抗体临床试验的患者提供保险。对此,Priya Singhal表示,“目前,我们的重点是确保收集数据的清晰明确,并将与FDA进行沟通。”艾伯维也在坚持着,除了AL003,其与Alector还在合作开发另一款用于治疗阿尔茨海默病的药物TREM2单抗AL002,目前处于II期临床阶段。为致力于AD新药研发,艾伯维早在2017年就与Alector达成合作,为此付出了2.05亿美元的预付款,以及承诺将要给出的2000万美元股权投资,共计2.25亿美元。决心不可谓不大。
6月29日,礼来中国宣布,其在中国申报的Donanemab注射液临床试验申请获得了国家药品监督管理局的批准。长久以来,AD一直是礼来积极投资的领域,可惜其花费30亿美金且被寄予厚望的solanezumab遭遇了多次临床失败。而这款Donanemab是礼来开发的另一款靶向β淀粉样蛋白(Aβ)斑块的抗体药物,针对神经系统的AD。该药于2021年6月,还获得了FDA的突破性疗法认定。据悉,donanemab此前已经在II期临床试验中达到主要终点,已启动在FDA的donanemab的滚动上市申请。礼来公司发言人Kristen Porter Basu在电子邮件中证实,礼来公司此前曾宣布打算在本季度末之前完成向FDA提出关于donanemab的加速审批请求。该药的II期临床研究TRAILBLAZER-ALZ的数据结果表明,该疗法在减少淀粉样蛋白的措施上已经显示出成功效果。与安慰剂相比,针对被称为N3pG的β淀粉样蛋白修饰形式的研究抗体donanemab使得早期症状性阿尔茨海默病患者的认知和日常功能的综合指标下降速度明显减慢。第三期Trailrunner-Alz-1项目的第一次试验预计将很快开始,测试这种新一代疗法的安全性和其在早期症状性阿尔茨海默病中的斑块降低能力。

来源:E药经理人
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。
 来源:米内网全球药物研发库
来源:米内网全球药物研发库

{replyUser1} 回复 {replyUser2}:{content}