超过150年历史却只有2款FDA批准疗法,致命顽疾能加速迎来创新疗法吗?
美国FDA将召集外部专家委员会,讨论Amylyx公司创新疗法AMX0035(苯丁酸钠和牛磺酸二醇口服固定剂量配方)治疗肌萎缩侧索硬化(ALS)患者的临床试验数据,是否支持它获批上市。这一疗法受到业界和ALS患者群体的广泛关注,因为ALS疾病领域目前只有两款FDA批准的疗法,而且它们不能显著改变疾病进程。对于这种致死率100%的疾病,患者急切需要创新治疗选择。
值得一提的是,这是关于这款疗法的第二次咨询委员会。今年3月,咨询委员会以6:4的投票结果,表示临床数据尚不支持这款疗法的有效性。之后,Amylyx公司递交了对临床试验数据的进一步分析以及来自其它临床试验的支持数据。AMX0035也首次获得加拿大监管机构的批准有条件上市。明日,咨询委员会将就这些数据是否支持该疗法获得FDA批准的问题进行投票。这一次结果是否会有所不同?

ALS(又名渐冻症)因为曾经风靡社交媒体的“冰桶挑战”而得到人们的广泛关注。患者大脑和脊柱的运动神经元会不断死亡,导致肌肉无力和瘫痪,从无法行走到无法说话、吞咽、呼吸。绝大多数患者在确诊后通常寿命只有3-5年。
虽然ALS早在150多年前就被发现,但是它的发病原因仍然没有得到完全澄清。在日前药明康德举办的“让科学引领” 罕见病公益系列论坛之肌萎缩侧索硬化(ALS)及神经肌肉疾病(NMD)主题专场上,西达赛奈再生医学研究所教授兼执行主任Clive Svendsen博士表示,ALS患者的运动神经元跟健康人的神经元到底有什么区别,仍然是个需要回答的复杂问题。基因突变与约10%的患者相关,环境因素也被认为起到了重要作用。由于发病机理不明,这给开发具有针对性的疗法增添了挑战。
Amylyx公司的AMX0035旨在跳过神经系统的复杂性,直接延缓神经细胞的死亡。在神经退行性疾病中,神经细胞的线粒体和内质网经常会出现异常。线粒体是细胞的“能量中心“,而内质网则是多种蛋白折叠的“厂房”,这两类细胞器的失常会导致蛋白折叠错误,能量代谢异常等问题,引起神经细胞的死亡。Amylyx公司的设想是,通过苯丁酸钠和牛磺酸二醇这两种药物改善细胞内线粒体和内质网的健康状态,从而延缓神经细胞的死亡。它们的优点是已经获得FDA的批准治疗其它疾病,因此拥有经过确认的安全性。Amylyx公司最初成立时,两名联合创始人约书亚·科恩(Joshua Cohen)和贾斯汀·克莱(Justin Klee)只有21和22岁。
这一疗法的效果得到一项2期临床试验CENTAUR的支持,接受治疗的患者在24周后,使用综合衡量ALS患者日常功能的ALSFRS-R评分,与安慰剂组相比,平均评分下降幅度显著减少。这项研究已经在《新英格兰医学杂志》上发表。在长期扩展试验中,接受治疗的患者与安慰剂组相比,中位生存期延长4.8个月。在这一临床试验中,原先接受安慰剂的患者在24周之后可以选择换为接受AMX0035治疗,这可能降低AMX0035组与安慰剂组之间的生存获益数值。在新递交的数据分析中,如果考虑到安慰剂组患者可以转换为接受AMX0035的治疗,调整后的生存获益从4.8个月增加到9.7个月。
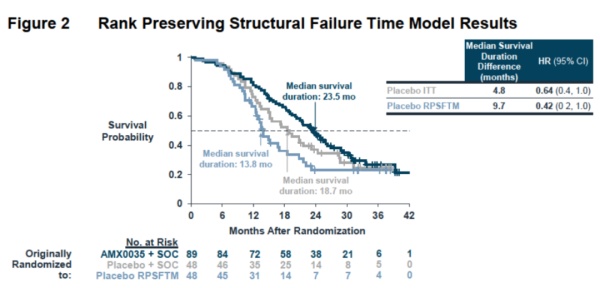
▲AMX0035的最新总生存期数据分析结果(图片来源:参考资料[2])
此外,Amylyx公司还比较了临床试验中接受AMX0035治疗的患者的生存期与根据ALS患者自然病史数据库预计的生存期。这一分析显示,接受AMX0035治疗的患者的生存期与根据自然病史预估的生存期相比,提高了9.9个月。
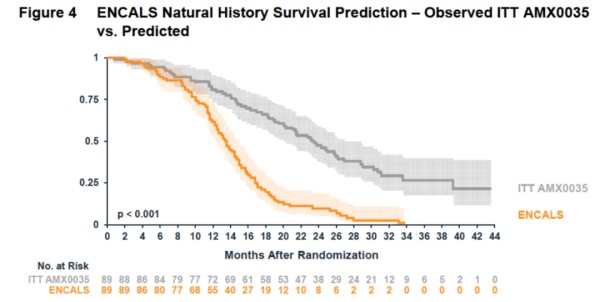
▲接受AMX0035治疗的患者总生存期与自然病史预测的总生存期相比获得提高(图片来源:参考资料[2])
Amylyx公司还递交了AMX0035用于治疗阿尔茨海默病患者的2期临床试验的生物标志物结果。这一结果显示,AMX0035能够在阿尔茨海默病患者中降低与神经退化相关的Tau蛋白和磷酸化Tau蛋白水平,与突触功能相关的neurogranin水平,和与炎症相关的YKL-40水平。这些生物标志物的变化可能为AMX0035的作用机制提供更多洞见。因为在ALS患者中,磷酸化Tau蛋白和YKL-40水平都显著升高。值得一提的是,Amylyx公司已经在开展一项验证性3期临床试验,计划在600名ALS患者检验AMX0035的效果,预计在2024年获得试验结果。
美国FDA近日也在官网上公布了对AMX0035的审评文件,文件在指出AMX0035新提交的数据分析和生物标志物数据的不足之处的同时,也重申了FDA拥有为具有显著未竟医疗需求的严重疾病批准创新疗法的“监管灵活性”(regulatory flexibility)。FDA明确指出,在明日的咨询委员会上,专家在考虑目前的数据是否支持AMX0035获得批准这一问题时,可以考虑ALS的严重未竟医疗需求、疾病的严重性、以及Amylyx公司正在进行的3期临床试验的状况。
不管会议结果如何,ALS领域在近年来得到更多的关注和研发投入。根据药明康德内部数据库的统计,截至今年5月底,已有近百款ALS候选药物进入临床开发阶段。其中,细胞疗法、多肽蛋白类药物,寡核苷酸疗法,基因疗法等多种新兴治疗模式有望为ALS的治疗带来更多可能性。
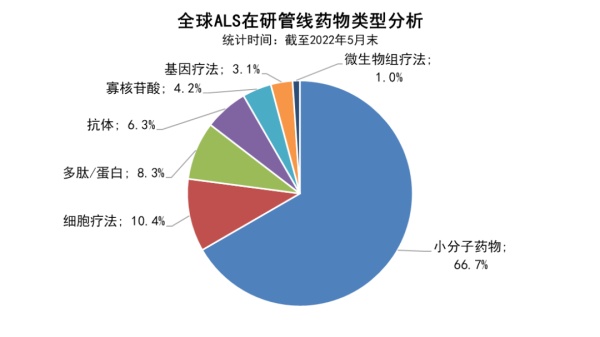
▲全球ALS在研管线药物类型分析(数据来源:药明康德内容部数据库;制图:药明康德内容团队)
美国FDA也在日前发布5年工作计划,旨在加快包括ALS在内的罕见神经退行性疾病的疗法开发。
在日前药明康德举办的肌萎缩侧索硬化及神经肌肉疾病主题专场上,ProMIS Neurosciences首席科学官,英属哥伦比亚大学荣誉教授Neil Cashman博士表示,在他投身ALS领域近40年的历史上,从来没有这么多人和这么多公司在致力于创新药物的开发和检测。期待在科学引领下,借助合作的力量和平台的力量,全行业将能更有效地应对挑战,全球患者能够早日迎来更多创新治疗选择。
来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}