一周盘点 | “量身定制”的治疗性癌症疫苗、多款癌症疗法早期临床数据亮眼
“量身定制”的治疗性癌症疫苗、多款癌症疗法早期临床数据亮眼。
·
·
·
1. 可“量身定制”的治疗性癌症疫苗VB10.NEO早期临床数据亮眼,在95%的患者中诱导广泛的T细胞反应。2. 同种异体T细胞免疫疗法ATA188可防止多发性硬化进展近四年。3. 24价潜在“best-in-class”肺炎球菌疫苗可为患者提供10-15%额外的保护力。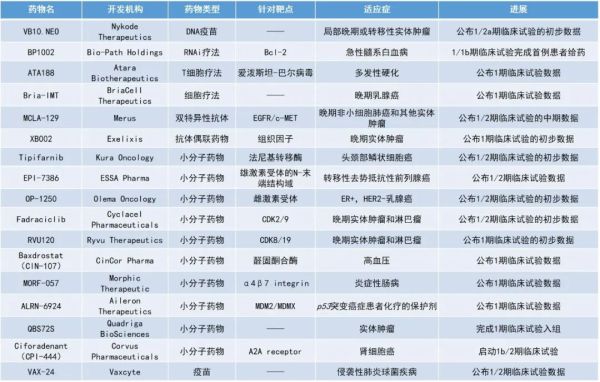
VB10.NEO:公布1/2a期临床试验的初步数据
Nykode Therapeutics公布了其专有的个体化治疗性DNA癌症疫苗于临床1/2a期试验中,治疗局部晚期或转移性实体肿瘤患者的初步积极安全性和免疫原性结果。新抗原是由正常组织中不存在的肿瘤特异性突变产生的蛋白质,可能被免疫系统识别为外来物从而引起抗肿瘤免疫反应,是癌症免疫治疗的潜在靶点。该疫苗旨在根据患者个人的新抗原谱进行个体化的生产。此次公布的数据显示,VB10.NEO在95%的患者中诱导了广泛的T细胞反应,包括新的和预先已存在的T细胞的扩增,大多数编码的新表位具有免疫原性并能诱导CD8+ T细胞反应。此外,多次接种疫苗能够提高免疫反应的广度和幅度,大多数T细胞反应维持了至少一年。安全性方面,VB10.NEO在实体瘤患者中通常具有良好的安全性和耐受性。
Atara Biotherapeutics更新了其靶向爱泼斯坦-巴尔病毒(EBV)的同种异体T细胞免疫疗法ATA188,用以治疗进行性多发性硬化(MS)患者的1期临床试验新进展。ATA188是Atara开发的研究性现货型同种异体T细胞免疫疗法,旨在针对进展型MS,特异性靶向感染EBV的B细胞和浆细胞,降低对神经髓鞘的攻击。此次公布的1期临床试验数据显示,大多数接受ATA188治疗的患者获得了长期且持久的临床残疾改善,所有达到稳定疾病的患者在48个月内持续保持稳定。此外,接受ATA188治疗并获得确认残疾改善的患者在42个月时的MRI图像纵向分析中,显示出脑萎缩显著减少。
Vaxcyte公布了其24价肺炎球菌结合疫苗(PCV)候选疫苗VAX-24的1/2期临床试验的积极数据。VAX-24是一种用于预防侵袭性肺炎球菌疾病(IPD)的研究性24价PCV候选疫苗,旨在通过覆盖大多数目前流行的肺炎球菌血清型来改进儿童和成人的PCV标准护理。该研究评估了VAX-24在18-64岁健康成年人中的安全性、耐受性和免疫原性。在这项临床试验中,VAX-24在所有研究剂量下均表现出与现有的20价PCV标准护理相似的安全性和耐受性特征。此外,VAX-24独有的4种血清型在所有剂量下均符合优效性标准,这4种增加的血清型覆盖了目前成人护理标准中引起IPD的10-15%的菌株。2022年8月,FDA授予VAX-24用于成人适应症的快速通道资格。BriaCell Therapeutics公布了其候选细胞疗法Bria-IMT与Incyte的PD-1抑制剂retifanlimab联合治疗晚期乳腺癌的1期临床试验数据。Bria-IMT是一种表达Her2/neu的人类乳腺癌细胞系,被设计能够产生和分泌乳腺癌抗原和粒细胞-巨噬细胞集落刺激因子(GM-CSF),促进基于树突状细胞的抗原呈递,激活免疫系统。此外,Bria-IMT还能够直接刺激抗肿瘤CD4+和CD8+ T细胞,进一步增强抗肿瘤免疫反应。该1期临床试验已经完成,结果显示Bria-IMT与retifanlimab的联合疗法在接受其他疗法失败的12例患者中显示出良好的安全性和耐受性,没有剂量限制性毒性。近期,Bria-IMT被FDA授予了快速通道资格。BP1002是一种中性电荷、掺入脂质体的反义RNAi药物,通过在mRNA水平而不是蛋白质水平上靶向Bcl-2,从而抑制Bcl-2的蛋白质合成。Bcl-2是一种参与阻断程序性细胞死亡的蛋白质,在多种肿瘤中过度表达,包括非霍奇金淋巴瘤和慢性淋巴细胞白血病。Bcl-2过表达的肿瘤细胞会对化疗耐药。BP1002有望克服目前不符合强化化疗条件的急性髓系白血病(AML)患者的护理标准venitoclax的耐药问题。Venitoclax也是一种口服Bcl-2抑制剂,靶向Bcl-2蛋白的BH3结构域。临床前研究显示,BP1002是针对Bcl-2的有效抑制剂,其良好的安全性应使BP1002能够与批准的药物进行联合治疗,并且BP1002与地西他滨的组合对venetoclax耐药的细胞有效。Merus公布了其双特异性抗体MCLA-129治疗晚期非小细胞肺癌(NSCLC)和其他实体肿瘤患者临床1/2期试验的中期数据。MCLA-129是一种全人源抗体依赖性细胞毒性(ADCC)增强型EGFR/c-MET双特异性抗体,具有两种互补的作用机制:阻断肿瘤的生长和生存通路以阻止其扩散,同时增强免疫效应细胞,从而消除肿瘤。此次公布的数据显示,MCLA-129的安全性和耐受性良好。在先前接受过治疗的多种肿瘤类型的患者中均观察到MCLA-129的抗肿瘤活性。18例可评估的患者中有2例达到了确认的部分缓解(PR),4例患者的肿瘤缩小>20%。Exelixis公布了其靶向组织因子的下一代抗体偶联药物XB002治疗晚期实体肿瘤的1期临床试验初步结果。组织因子在多种实体瘤中过表达。XB002与肿瘤细胞上的组织因子结合后被内化,会释放出细胞毒性药物,导致肿瘤细胞的死亡。此前,靶向组织因子的分子具有影响凝血级联反应的局限性,但临床前研究显示,XB002不会影响凝血级联反应。此次公布的数据显示,XB002在多个剂量水平下耐受性良好。药代动力学分析显示,XB002在输注后能够保持稳定,并具有在释放其细胞毒性药物之前达到靶细胞的能力。Tipifarnib:公布1/2期临床试验的初步数据Kura Oncology公布了其法尼基转移酶抑制剂tipifarnib与alpelisib联用治疗HRAS和/或PIK3CA依赖性头颈部鳞状细胞癌(HNSCC)患者的1/2期临床试验的初步数据。HRAS是一种原癌基因,它是一种正常基因,由于突变或表达增加而可能成为癌基因。HRAS在某些头颈部鳞状细胞癌中发生突变和/或表达。法尼基转移酶是调控HRAS活性的关键酶。此次公布的数据首次证明了该联合疗法可以在PIK3CA依赖性的HNSCC中,实现持久的临床反应。临床前数据显示,该疗法有潜力对约45%的HRAS过度表达和/或携带PIK3CA突变的HNSCC肿瘤患者起效。Olema Oncology公布了其候选药物OP-1250治疗晚期和/或转移性雌激素受体(ER)阳性、HER2阴性乳腺癌患者的1/2期临床试验的初步数据。OP-1250是一种具有完全ER拮抗剂(CERAN)和选择性ER降解剂(SERD)这两种双重活性的口服小分子药物。此次公布的数据显示,OP-1250耐受性良好,具有良好的药代动力学(PK)和药物暴露水平。此外,OP-1250还表现出了强大的抗肿瘤活性和持久的益处,41%的患者的病灶有缩小,57名疗效可评估的患者中有6例达到PR(4例确认,2例未确认)。此前,OP-1250已获得了FDA授予的快速通道资格。ESSA Pharma公布了其第二代抗雄激素药物EPI-7386与恩杂鲁胺(enzalutamide)联合疗法,以治疗转移性去势抵抗性前列腺癌(mCRPC)患者的临床1/2期试验中前两个队列的最新数据。EPI-7386是一种高选择性的雄激素受体N-末端结构域的口服小分子抑制剂。研究结果显示,该组合疗法的耐受性良好,安全性与第二代抗雄激素药物一致,且未观察到剂量限制性毒性。此前,FDA已授予EPI-7386快速通道资格,用于治疗对标准护理治疗耐药的mCRPC成年男性患者。Fadraciclib:公布1/2期临床试验的初步数据Cyclacel Pharmaceuticals公布了其口服候选药物fadraciclib,用于治疗晚期实体瘤和淋巴瘤患者的1/2期临床试验的初步数据。Fadraciclib是一种细胞周期蛋白依赖性激酶(CDK)2/9抑制剂。CDK对于细胞周期控制和转录调控至关重要,CDK2能够驱动细胞周期转变,CDK9则能够调节基因的转录。Fadraciclib可以通过抑制CDK2和CDK9引起癌细胞凋亡死亡。此次公布的数据显示,fadraciclib的耐受性良好,在可评估的18例患者中,接受治疗的T细胞淋巴瘤患者中有2例达到PR,15例各种实体瘤患者中有11例达到疾病稳定(SD)。截至目前,尚未观察到剂量限制性毒性。Ryvu Therapeutics公布了其CDK8/19抑制剂RVU120治疗复发/难治性转移或晚期实体肿瘤患者的1/2期临床试验的初步数据。结果显示,RVU120在所有评估剂量下均具有良好的耐受性,未观察到剂量限制性毒性。可评估的11例患者中,4例达到了SD,其中3例实现了超过4个月的SD。临床前数据显示,RVU120具有增强ADCC促进药物治疗的潜力。CinCor Pharma公布了其用于治疗高血压的baxdrostat的1期临床试验数据。Baxdrostat(CIN-107)是一种高选择性的口服小分子醛固酮合酶抑制剂,作用于肾素-血管紧张素-醛固酮调节系统,用于治疗耐药性高血压和原发性醛固酮增多症。此次公布的研究结果显示,baxdrostat的耐受性及药代动力学特征良好,半衰期支持每日一次口服给药。此外,血浆醛固酮的剂量依赖性减少以及不会对皮质醇造成影响,加强了baxdrostat选择性阻断醛固酮合酶的作用。Morphic Therapeutic公布了其选择性口服小分子α4β7整合素(integrin)抑制剂MORF-057用于治疗炎症性肠病(IBD)的1期临床试验结果。MORF-057旨在阻断淋巴细胞表面的α4β7与粘膜内皮细胞配体MAdCAM-1之间的相互作用,从而显著减少淋巴细胞从血液迁移到肠粘膜组织并引起与IBD相关的炎症。在该1期研究中,所有剂量均耐受性良好,未发现安全信号,并观察到良好的药代动力学特征。Aileron Therapeutics公布了其ALRN-6924在健康受试者中的1期临床试验结果。ALRN-6924是一种潜在“first-in-class”的MDM2/MDMX双重抑制剂,旨在作为一种用于p53突变癌症患者的新型选择性化学保护剂。ALRN-6924被设计为通过激活p53,进而上调p21(一种已知的细胞复制周期抑制剂),从而诱导细胞周期停滞,以保护正常、健康的细胞免受化疗造成的损伤。此次公布的数据显示,ALRN-6924具有预防化疗引起的中性粒细胞减少症、血小板减少症、贫血以及化疗诱导的脱发的潜力。ALRN-6924在较高剂量下的作用程度更大,持续时间更长。此外,ALRN-6924在3分钟静脉推注和1小时静脉输注情况下显示出相似的安全性、药代动力学和药效学,为未来开发简化推注给药提供了依据。QBS72S是一种新型的模拟芳香族氨基酸的潜在“first-in-class”化学治疗剂,用于治疗晚期实体肿瘤。QBS72S能够被L型氨基酸转运蛋白1(LAT1)摄取进入细胞,从而能够穿过血脑屏障(BBB)。大多数侵袭性癌症表达高水平的LAT1,这通常与预后不良有关。因此,QBS72S能够选择性地靶向多种类型的快速生长的癌细胞。一旦进入细胞,QBS72S会导致双链DNA断裂,引起细胞的死亡。ciforadenant(CPI-444):启动1b/2期临床试验Ciforadenant(CPI-444)是一种口服A2A受体小分子抑制剂,旨在通过阻断肿瘤微环境中腺苷与A2A受体的结合,使肿瘤破坏免疫系统的能力失效。腺苷是三磷酸腺苷(ATP)的代谢物,在肿瘤微环境中产生,它能与免疫细胞上存在的腺苷A2A受体结合并阻断其活性。临床前研究显示,使用ciforadenant与CTLA-4抑制剂和PD-1抑制剂联用能够控制或完全消除肿瘤。此次开展的1b/2期临床试验旨在评估ciforadenant与CTLA-4抑制剂ipilimumab和PD-1抑制剂nivolumab联用一线治疗肾细胞癌的疗效。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。









{replyUser1} 回复 {replyUser2}:{content}