2021年,被称为国内医药创新成果的收获之年。80种新分子(未在中国境内上市销售的药品)首次在中国上市,国内新药获批再创新高,首款 CAR-T 疗法、首款国产 ADC、首款国产 PD-L1 单抗……药审改革和鼓励创新的政策推动,让创新投入在这一年收获了累累硕果。
2021年底,国家药品评审中心登记的创新药相关临床试验共501项,其中Ⅲ期临床共106个。因此,行业曾预测,未来3-5 年,我国创新药上市将迎来爆发。所有人都对2022年的创新成果充满了期待。根据公开信息的不完全统计,截至11月17日,NMPA共批准了43款新药,其中本土新药24款。这一数据相较去年相比有了大幅下滑,根据医药魔方Bydrug的数据,去年同期共批准了62款新药,其中,国产新药32款。无论从整体数量还是本土新药获批数量来看,均下滑了30%左右。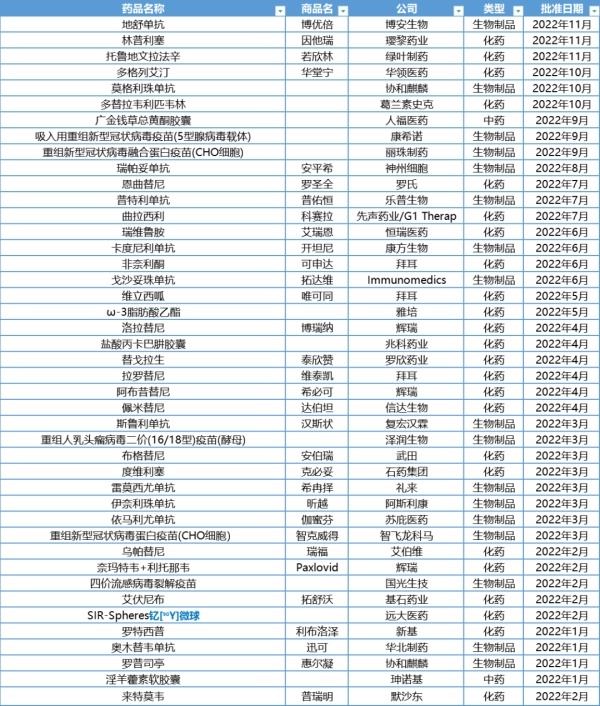
注:根据公开信息整理,因统计口径不同,可能会有差异从获批类型(按照CDE分类)来看,化药获批了24个品种,占据了近一半;生物制品(包括疫苗)获批了17个 ,与去年保持持平,但是从占比上看,生物药有了大幅提升;中药截至目前获批两个,不及去年同期的一半。从覆盖领域来看,肿瘤领域依然是获批最多的赛道,但在此前CSCO大会上,CDE副主任杨志敏发布了《2022年中国抗肿瘤新药审评报告》,截至2022年10月,在2022年获批上市抗肿瘤新药NDA(含新增适应证)55款,其中21个为首个上市的适应证。首次获批上市的新药近3年总体持平,但2022年新增适应证的药物较2021年有所降低。此前,E药经理人曾基于NDA申报信息预测了36家药企的41款即将在中国上市的新药,从已获批情况来看,有多格列艾汀、瑞维鲁胺等成功上市的9款药物,也有像普那布林这样被打入“冷宫”,不止何时“复宠”的品种。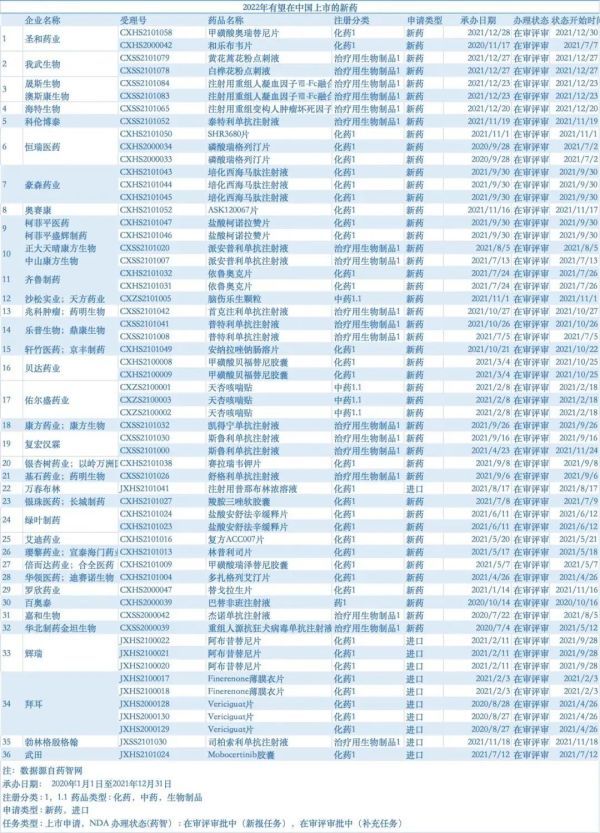
从国内获批的品种来看,与去年相比,既有惊,也有喜,还有争议与无奈。随着3月份和7月,复宏汉霖的斯鲁利单抗和乐普生物的普特利单抗获得药品批准证明文件,国内PD-1市场迎来了10款产品同台竞技的场面。目前,百济神州的替雷利珠单抗已经在国内申报上市了11项适应证,信达的信迪利单抗也已经获批7个适应证,恒瑞的卡瑞丽珠单抗也有8个适应证在手……11月15日君实生物宣布已就特瑞普利单抗向欧洲药品管理局(EMA)提交上市许可申请,适应证为联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌(NPC)患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌(ESCC)患者的一线治疗。特瑞普利单抗是国产PD-1中最先以鼻咽癌向欧洲进军的,此前百济神州和恒瑞也已经在欧洲相关地区的业务有所布局。无论将PD-1的竞争形容成百花齐放也好,同质化也罢,PD-1的比拼,已经进入了第二战场:新适应证扩展和新市场。6月29日,康方生物自主研发的 PD-1/CTLA-4 双特异性抗体卡度尼利单抗注射液正式获批上市,用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者。这是国内企业自主研发的首款双特异性抗体药物,也是全球第一个获批上市的基于 PD-1 的双特异性抗体药物,同时,卡度尼利单抗也有可能在今年的医保谈判中出现。在PD-1成为“卷王”的情况下,双抗成为下一个热门竞争领域,根据医药魔方数据统计,目前全球共有超过700款双抗在研药物,但仅有两款新药处于NDA阶段。2022年1月10号,珅诺基的淫羊藿素软胶囊成为首个获批上市的国产1类创新药,也是今年以来唯二获批的中药创新药。这是首个针对IKKα靶点的药物,根据药融云数据库,显示目前仅有5项研究针对此靶点展开,并且均处于药物发现阶段。上市之后,便引发了关于其在临床、疗效等方面的争议。伴随着争议,珅诺基依然迅速的与华东医药达成了商业化的合作。2021年,恒瑞不惜重金引入的两款新药,璎黎药业的PI3Kδ抑制剂林普利塞与大连万春布林的普那布林,都曾被认为是最有可能在今年上市的新靶点创新药。随后,普那布林FDA受阻,前景成谜,而今年一月吉利德、Incyte相继在PI3Kδ抑制剂上受挫,一度让市场怀疑恒瑞的“眼光”。不过,随着普利塞的正式获批,不仅让市场的“石头”落了地,也给了恒瑞一个意外之喜。但恒瑞另一款备受关注的新药,瑞格列汀却没有如预期中上市。早在2009年,恒瑞医药的磷酸瑞格列汀临床研究就进行了中美双报,并获得了批准。此后,瑞格列汀经历过申请上市再撤销,命运多舛。恒瑞想要冲击糖尿病市场,前景依然不明晰。另一家正在冲击糖尿病领域的biotech——华领医药则斩获了自己的first-in-class,10月8日,NMPA宣布已批准华领医药1类新药多格列艾汀片上市,用于改善成人2型糖尿病患者的血糖控制。这不仅是华领医药第一款即将商业化的产品,也是GKA类糖尿病治疗药物的全球首个新药。值得关注的是,今年依然有3款新冠疫苗获批,其中在进博会前期获批并开始接种的康希诺吸入用重组新型冠状病毒疫苗“刷屏”了行业与资本市场,并成功带动了相关概念股的大涨。在宣布开始接种之后,康希诺股价在七天内大涨累计超过了160%。在今年的进博会上,各家跨国药企不约而同的释放出了一个信号:加速创新产品在中国的上市。继2021年12月22日,美国FDA官网宣布辉瑞旗下口服抗新冠病毒药物奈玛特韦片/利托那韦片组合(Paxlovid)获得紧急使用授权,用于治疗12岁以上、轻中度新冠肺炎患者以后,2022年2月12日,中国国家药监局按照药品特别审批程序,附条件批准辉瑞公司Paxlovid的进口注册。虽然,P药的快速实现全球同步,有疫情催化的原因,但不可否认的是,其在开年便打开了跨国药企创新产品快速入华的局面。除了P药之外,辉瑞还在国内上市了两款新药:洛拉替尼(博瑞纳)和阿布昔替尼(希必可),其中,Janus激酶(JAK)1抑制剂阿布昔替尼,于2022年1月14日获美国FDA批准上市,同年便进入国内。拜耳今年同样在国内上市了三款产品,其中,唯可同(维立西呱)去年1月刚在FDA获批,另一款产品非奈利酮片于2021年7月9日获美国FDA批准上市许可,2022年2月16日获欧洲药品管理局(EMA)批准上市许可,2022年3月获日本PMDA批准上市许可。整体来看,今年在国内获批的海外新药,已从此前的5-10年,加速到现在的1-2年,甚至出现了几乎同步上市的情况。据了解,在未来,不仅将会实现更多全球创新产品的同步上市,也将会出现全球创新中国首发的局面。从此前跨国药企的财报来看,在中国市场动辄两位数的增长存在众多不确定性,随着集采的进一步推进,无疑,成熟产品躺着赚钱的日子已经一去不复返,想要在这个全球第二大市场中仍旧占据一席之地,能拼的,最终必然是他们最擅长的产品研发和潜力品种的驱动。而缩短中美上市时间差距,将会成为未来跨国药企们的常规动作。上市放缓,未来3-5年还能迎来本土创新产品爆发吗?
2002年,《药品注册管理办法》首次颁布试行版本,药品注册的概念第一次被明确提出;2015年中国药审改革拉开序幕,清除药品审评审批积压问题,同时加快药物审评审批速度等一系列鼓励新药创制、提升药品质量、促进产业升级的政策出台;从2018年开始,由于药政改革的助推,中国创新药产业逐渐进入收获期,每年都有近十款国产新药获批上市,医药创新逐渐由“本土新”开始向着“全球新”迈进。 然而,2022年已接近“收官”,创新药获批却未出现增长反而下降。为何会出现这种情况?对于创新的鼓励,无疑依然会是不变的趋势和方向。也正是在这种鼓励之下,靶点扎堆、研发内卷,同质化问题严重,本土新药研发面临着与以往不同的挑战。市场对于创新药期待值下降,资本市场寒冬依旧在持续。二级市场破发、一级市场融资困境、产品商业化不利……创新药企也开始反思自己的“地位”,裁员、卖厂,成为不少biotech当下最紧急的动作。2021年7月2日,CDE发布了《以临床价值为导向的抗肿瘤药物临床研发指导原则》向社会公开征求意见,被业内称为继2015年《关于开展药物临床试验数据自查核查工作的公告》开始“史上最严的核查”之后的又一个“7·22惨案”。如何进行高层次的创新、提升源头创新能力,解决未满足的临床需求,“以患者为中心、以临床价值为导向”的药物创新导向,对新药研发提出更高的标准后,让不少试图将触手伸向me too领域的企业心存忌惮。最直观的现象是,从研发靶点上来看,虽然今年整体数量有所下降,但是质量有所上升,去年竞争激烈的CD19、CD20、HER2、EGFR、PARP等热门靶点在今年有所降温,神经、自免等新领域已经开始集中发力。无疑,创新药研发已经从上半场的集体出发,进入了考验源头创新的淘汰阶段。随着获批产品几乎“断崖式”的下降,研发同质化的持续,疫情对于供应链稳定保障的影响,地缘政治等不确定因素的担忧,未来的中国创新产品能否迎来爆发期?“源头活水”又将从哪儿来?明年还会有哪些新靶点出现?哪些产品将会进入生死搏斗阶段?疫苗还能“吃”到新冠红利吗?细胞与基因治疗领域会不会迎来新产品?欢迎留言讨论。







{replyUser1} 回复 {replyUser2}:{content}