71%客观缓解率的CAR-T疗法、阿尔茨海默病疫苗临床试验积极… | 一周盘点
71%客观缓解率的CAR-T疗法、阿尔茨海默病疫苗临床试验积极。
·
·
·
1. Allogene Therapeutics宣布,其用以治疗复发/难治性多发性骨髓瘤(RRMM)的现货型CAR-T疗法ALLO-715的1期临床试验数据发表于《自然》子刊Nature Medicine。此疗法客观缓解率为71%,其中46%的患者达到非常好的部分缓解。2. AC Immune宣布,其抗β淀粉样蛋白(Aβ)疫苗ACI-24.060,在前驱期(prodromal)阿尔茨海默病患者中进行的1/2期临床试验中获得积极安全性和免疫原性结果。3. Orbsen Therapeutics宣布,患有2型糖尿病导致的糖尿病肾病(DKD)患者,经过单剂静脉注射其在研细胞疗法ORBCEL疗法18个月后,与安慰剂相比,肾功能指标获得统计显著改善。4. Enlivex Therapeutics宣布,其旨在对巨噬细胞进行重编程的现货型细胞疗法Allocetra,在晚期实体瘤患者中展现良好安全性,以色列卫生部(IMOH)批准较高剂量的Allocetra作为单药或PD-1抑制剂组合疗法的临床试验申请。药明康德内容团队整理
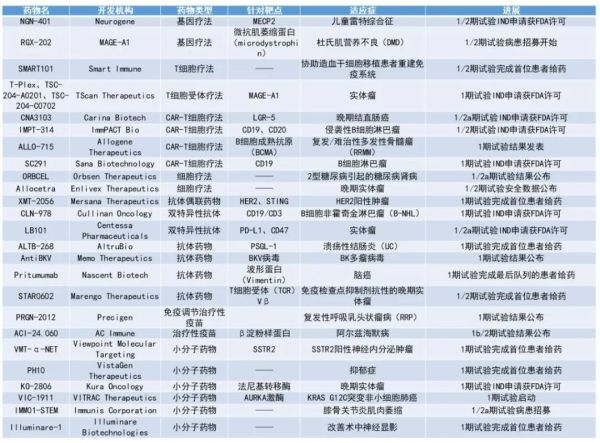
NGN-401:1/2期试验IND申请获FDA许可Neurogene近日宣布其在研基因疗法NGN-401的IND申请获FDA批准,将在今年针对雷特综合征(Rett Syndrome)儿童患者进行临床1/2期试验。雷特综合征是一种X连锁、渐进式的神经发育障碍,每1万位出生的女婴中,会有一位罹患此病,是在女性中最常见的发育、智力障碍遗传性疾病。雷特综合征是由于MECP2基因突变导致此蛋白生产量不足,因此其所参与的脑部与神经系统正常功能受到影响,患者智力通常停留在6-18个月的年龄。新闻稿指出,NGN-401是首个递送全长MECP2基因的在研腺相关病毒(AAV)疗法,是通过Neurogene专有的EXACT基因调节科技平台所开发,并在临床前试验中展现良好的疗效与安全性。T-Plex、TSC-204-A0201、TSC-204-C0702:1期试验IND申请获FDA许可TScan Therapeutics近日宣布其三款用以治疗癌症的在研T细胞受体(TCR)疗法,其IND申请获FDA批准。其中T-Plex为TScan实体瘤项目的主要项目,此疗法根据患者肿瘤所表达的人类白细胞抗原(HLA)种类,进行个体化的TCR疗法组合。而TSC-204-A0201、TSC-204-C0702则是靶向由HLA-A 02:01与C*07:02呈递的MAGE-A1。MAGE-A1是一种过度表达的癌症相关抗原,表达于45%的头颈癌,以及50%的黑色素瘤、宫颈癌以及非小细胞肺癌。CNA3103:1/2a期试验IND申请获FDA许可Carina Biotech近日宣布,其靶向LGR5的在研CAR-T疗法CNA3103的IND申请获FDA批准,将在晚期结直肠癌患者中进行临床1/2a期试验。LGR5为癌症干细胞的生物标志物,高度表达于晚期结直肠癌与其他癌症当中。LGR5的表达与结直肠癌患者的不良预后相关。临床前实验显示,Carina专有的CNA3103可在一次给药后,达成肿瘤完全消退且没有肿瘤复发的情形,并延长实验动物的生存期。IMPT-314:1/2期试验IND申请获FDA许可ImmPACT Bio近日宣布,其在研CAR-T疗法IMPT-314获FDA批准其IND申请,并预计于今年第1季度进行临床1/2期试验。IMPT-314是一款同时靶向B细胞抗原CD19与CD20的自体CAR-T细胞疗法。在即将进行的1/2期试验当中,会在包含弥漫性大B细胞淋巴瘤(DLBCL)在内的侵袭性B细胞淋巴瘤中,检视IMPT-314的疗效与安全性。在之前早期的临床试验当中,IMPT-314在非霍奇金淋巴瘤(NHL)患者中达到90%的客观缓解(9/10),并有70%的患者达成持续性的完全缓解(7/10),在中位追踪期超过20个月的期间,患者的中位无进展生存期达18.2个月。近日Allogene Therapeutics宣布,其用以治疗复发/难治性多发性骨髓瘤的现货型CAR-T疗法ALLO-715的1期临床试验数据发表于《自然》子刊Nature Medicine。ALLO-715是一种靶向B细胞成熟抗原(BCMA)的现货型CAR-T细胞疗法。2021年8月,美国FDA授予ALLO-715治疗多发性骨髓瘤(MM)的孤儿药资格。在去年12月的美国血液学会(ASH)年会当中,Allogene公布了ALLO-715的1期临床试验结果。截至2021年10月14日,43名复发/难治性多发性骨髓瘤患者接受了ALLO-715的治疗。在接受氟达拉滨、环磷酰胺和抗CD52抗体ALLO-647联用的淋巴细胞清除方案后接受剂量为320 x 10^6 CAR-T细胞治疗的患者亚群(n=24)中,客观缓解率为71%,其中46%的患者达到非常好的部分缓解,25%的患者达到完全缓解或严格完全缓解。发布于Nature Medicine的数据显示,在UNIVERSAL临床1期试验中,达92%入组的患者接受治疗,且以ALLO-715治疗的RRMM患者呈现持久的缓解以及可控的安全性。Sana Biotechnology近日宣布,其在研靶向CD19自体CAR-T疗法SC291获FDA批准IND申请,将于各式B细胞淋巴瘤患者中进行临床试验。Sana预计在今年公布SC291的临床数据,并预计在今年递交第二项IND,检视其另一自体CAR-T疗法SC262的临床疗效与安全性,此疗法则靶向CD22。SC291与SC262皆通过Sana专有的低免疫性平台开发。此平台旨在通过破坏细胞上主要组织相容性复合体(MHC)I与II的表达,以克服CAR-T细胞受免疫系统攻击而造成的排斥反应。近日,Orbsen Therapeutics公布其在研细胞疗法ORBCEL,于患有2型糖尿病导致的糖尿病肾病(DKD)患者的临床验证试验积极结果。公布的中期分析结果为在接受最低剂量(8000万个细胞)ORBCEL疗法(n=12)与安慰剂组(n=4)的数据。分析显示,在18个月后,经过单剂静脉注射ORBCEL疗法的患者,与安慰剂组相比,其相对基线的肾功能维持统计显著改善,这是基于病患血清肌酐所预估的肾小球过滤速率所评估。ORBCEL所显示的安全性与耐受性与安慰剂组相似,试验中没有发现治疗相关的不良反应。接受第二剂量水平(1.6亿个细胞)的患者已于去年完成入组,并预计于今年下半年公布中期分析结果。DKD患者占了约30-40%的2型糖尿病患,这些病患即便经过标准治疗,仍会发展成慢性肾病,因此具显著的未竟医疗需求。导致DKD的重要因素之一为引起炎症与抗炎症免疫细胞的失衡。ORBCEL是一款源自病患骨髓,现货型的自体间充质细胞免疫疗法,开发用以治疗DKD。Enlivex Therapeutics近日宣布,其于晚期实体瘤患者身上正在进行中的在研细胞疗法Allocetra临床1/2期试验,已通过独立数据与安全监测委员(DSMB)会完成其预定的数据分析,而以IMOH亦通过试验扩增队列的监管申请。DSMB检视第一队列中所入组3位病患的安全性数据,这些患者接受每周一次共3次,低起始剂量的Allocetra单药治疗。DSMB并无发现安全性问题与任何致死情形。根据此数据,IMOH批准进行另外两个队列的试验,这两个队列将使用较高剂量的Allocetra作为单药或与PD-1抑制剂组合的疗法。Allocetra为一通用、现货型细胞疗法,旨在对巨噬细胞进行重编程,以恢复其稳态(homeostasis)。不稳定的巨噬细胞会造成许多像是实体瘤、脓毒症疾病的进展,通过恢复巨噬细胞的稳态,Allocetra提供创新的免疫调节机制,具潜力作为单药或组合疗法治疗这些具高度未竟医疗需求的疾病。近日,Cullinan Oncology宣布其在研T细胞衔接抗体CLN-978获FDA批准IND申请。Cullinan将针对CLN-978治疗复发/难治性B细胞NHL患者进行临床1期试验。CLN-978是一款现货型、延长半衰期的靶向CD19、CD3双特异性T细胞衔接抗体。CLN-978由两个抗体单链可变区片段(scFv)组成,此二scFv分别靶向高度表达于肿瘤细胞的CD19蛋白与表达于T细胞的CD3蛋白,能够通过活化T细胞介导的毒杀反应杀死癌细胞。Centessa Pharmaceuticals近日宣布,其在研双特异性抗体LB101获FDA批准IND申请用以治疗实体瘤患者。LB101是由Centessa专有LockBody平台所开发的条件性四价双特异性单克隆抗体。此抗体具有两个靶向CD47的蛋白域,此二蛋白域与另两个靶向PD-L1的蛋白域相连,并为其所阻断。当相连区域在肿瘤微环境中被自然分解时,靶向CD47蛋白域功能被释放,进而活化CD47分子在肿瘤中的效应功能以杀死癌细胞,并同时避免系统性毒性的产生。近日,Memo Therapeutics公布其在研抗体AntiBKV于治疗肾移植病患BK多瘤病毒感染的临床1期试验结果,分析显示试验达成其安全性与耐受性的主要终点。在此单盲、部分随机、安慰剂为对照的试验当中,共有40位健康志愿者入组,分别接受单剂与多剂AntiBKV上升剂量的注射。即便在最高的剂量下(2000 mg),试验中没有观察到相关的不良反应,且药代动力学数据正常、线性相关。公司预计在今年第1季度递交IND申请以进行多中心试验。由于使用免疫抑制药物,有40-50%的肾移植病患会有BK多瘤病毒感染活化的情形,造成严重的不良反应,并影响移植肾脏功能与患者生存。目前除了降低所使用免疫抑制剂的剂量外,没有其他能够改变疾病的疗法。AntiBKV为开发用以靶向BK多瘤病毒的潜在抗体药物。近日,Precigen公布其在研免疫疗法PRGN-2012的临床1期试验,治疗复发性呼吸乳头状瘤病(RRP)患者的剂量爬坡与扩增队列数据。数据显示,病患经过PRGN-2012重复给药仍呈现良好的耐受性,没有发现剂量限制毒性与超过2级的治疗相关不良反应。此外,PRGN-2012亦显示可有效治疗RRP患者,有50%病患达成完全缓解,在经过第2剂量水平的PRGN-2012治疗后,于最少12个月的追踪期内,不再需要进行手术治疗。RRP患者在12个月期间所需进行手术次数,从接受PRGN-2012疗法前的6.5次,缩小为接受疗法后的0.5次。Precigen预计招募32位病患,以第2剂量水平进行临床2期试验。RRP是一种罕见、难以治疗的致死性肿瘤疾病,是由于下呼吸道受人乳头状瘤病毒(HPV)6或11感染所造成,目前并无获批疗法。PRGN-2012是一种治疗性疫苗,能够激发对抗受HPV6或HPV11感染细胞的免疫反应。在临床前试验中,PRGN-2012显示可引发强烈、具专一性的抗HPV6与HPV11的免疫反应。PRGN-2012获得FDA授予孤儿药资格,用以治疗RRP患者。近日,AC Immune公司宣布,其抗β淀粉样蛋白(Aβ)疫苗ACI-24.060,在前驱期阿尔茨海默病患者中进行的1/2期临床试验中获得积极安全性和免疫原性结果。基于这些结果,试验将扩展至包括唐氏综合症患者,并且将在阿尔茨海默病患者中检验更高剂量的疫苗。试验的中期结果显示ACI-24.060在最初的低剂量队列中表现出良好的耐受性,未发现安全问题。同时,低剂量ACI-24.060最快在接种后第六周(接种第二剂疫苗后两周)就激发抗Aβ抗体反应。基于这些结果,接种高剂量的AD患者队列已经启动,而且这项研究获准开始招募唐氏综合征患者,这些患者阿尔茨海默病风险增高。ACI-24.060是基于AC Immune公司SupraAntigen平台开发的抗Aβ疫苗,旨在激发针对Aβ寡聚体和焦谷氨酸Aβ的多克隆抗体反应。Kura Oncology近日宣布,其在研药物KO-2806获FDA批准IND申请,用以治疗晚期实体瘤患者。Kura预计检视KO-2806作为单药或与其他靶向药物作为组合疗法的安全性、耐受性与初步抗肿瘤能力。KO-2806为一款潜在法尼基转移酶抑制剂药物。临床前研究显示,法尼基转移酶抑制剂与其他靶向疗法组合,具潜力克服由部分药物引起的抗性。

来源:药明康德
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。
















{replyUser1} 回复 {replyUser2}:{content}