Science:通往心脏的分叉路
先天性心脏病是最常见的出生异常之一,通常会影响心脏或心脏细胞类型的特定区域,而了解早期心脏谱系多样化对揭示先天性心脏病的起源至关重要。此外,将多能干细胞定向分化为特定的心脏谱系,是心脏疾病进行药物测试和再生疗法的关键步骤。
根据近期 science 的一篇报道,研究人员使用单细胞 RNA 测序,在早期小鼠胚胎的新生心血管胚层中产生了两个高分辨率的基因表达快照。这一发现说明了前心内胚层的转录复杂性,并揭示了在胚胎发生过程中,对心脏起作用的不同谱系是如何产生的。
图片来源:网络
细胞命运选择的调控机制
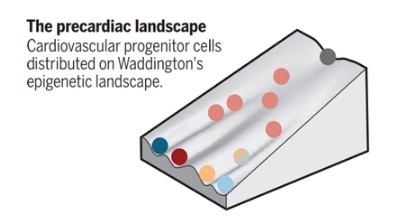
了解在谱系多样化过程中驱动细胞命运选择的调控机制,是发展生物学的一个核心目标。通过将许多独立细胞的转录内容划分到不同的地方,单细胞转录本可以预示一场在我们的掌握中革命——细胞命运的决定是如何发生的。(见下图)。这种技术可以改变我们对生物复杂性的认识,并帮助我们在体内平衡和疾病的发展过程中发现新的细胞类型和调节机制。
图片来源:science(DOI: 10.1126/science.aat0230 下同)
新生心脏的形成
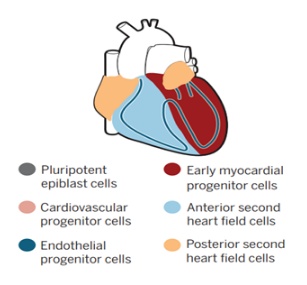
在胚胎发育过程中,心脏祖细胞在原肠胚中瞬时表达转录因子中胚层后蛋白 1(Mesp1)。新生儿的心脏中胚层迁移到胚胎的外侧区域,在那里,第一个心脏区域的祖细胞产生早期的心脏管。随后,晚期分化为第二心脏的多能祖细胞,这有助于从邻近的咽中胚层的心脏生长。第二心脏细胞产生心脏的静脉和动脉极,这里是先天性心脏缺陷的热点区域。在表达 Mesp1 之前,第一个和第二个心脏场分开。
单细胞 RNA 测序确定心脏细胞谱系的多样化
单细胞 RNA 测序最近提供了人们对不同区域和发育中心细胞类型的转录多样性程度的深入了解,为发现与心脏病相关的新途径和基因提供了宝贵资源。Lescroart 等人早期将注意力集中在 mesp1 表达的细胞上,当该基因表达在第一和第二心脏场祖细胞上时,这些新数据完全符合由前原肠胚细胞和后来的中胚层所产生的单细胞转录组间的发育连续体。使用聚类算法来显示这些组合数据集中的基因表达拓扑结构,作者确定了早期谱系多样化的不同祖细胞亚群。这些细胞包括心肌细胞和内皮祖细胞(可能是第一心脏起源细胞),以及具有咽中胚层遗传标志的细胞(被定义为第二心脏细胞的后部和前部簇),其中后者包括头部肌肉祖细胞。在发育的后期阶段,后部和前部第二心脏细胞分别对心脏的静脉和动脉弓起作用。此外,研究者还发现不同的祖细胞簇出现在分子异质心血管祖细胞核心的边缘。
Distinct progenitor cell clusters emerge at the edge of a transcriptionally heterogeneous core of nascent cardiovascular mesoderm
研究进展
Lescroart 等人计算了时间的轨迹,以追踪多能性外胚层和不同的祖细胞状态在转录谱上的进展。分析结果显示,前部和后部第二心脏场集群不同于表达中心核内两个谱系中富集的基因的普通祖细胞。在基底脊索动物肠道中 Mesp1 标记的心肌和咽肌祖细胞中观察到这种多谱系引发,表明这是咽中胚层细胞命运分离的保守特征。核心群体内的细胞可能因此构成不同轨迹之间的过渡状态,其中外在信号事件影响谱系结果。在遗传或环境摄动的情况下,核心人群的转录异质性将带来发育的可塑性和稳健性,从而可能导致先天性心脏缺陷患者的代偿机制和表型变异。
挖掘由 Lescroart 等人生成的数据集有助于用系统的方法界定控制早期中胚层顺序命运决定的外在和内在监管机构,例如,作者将 Notch 信号转化为内皮细胞与心肌轨迹早期富集的 Mesp1 调控通路。此外,来自突变胚胎的单细胞的转录组分析显示,Mesp1 本身控制从多能性向祖细胞规格的转变。
Distinct progenitor cell populations give rise to diferent regions of the heart and cardiac cell types
遇到的挑战
单细胞转录组学分析的一个主要挑战是将细胞映射到起源组织。使用荧光原位杂交追踪选定的基因,作者发现,心肌和心内膜祖细胞可以在新生中胚层中进行空间分辨,也可以在咽喉前后部区域进行区分。
近期开发的用来绘制 RNA 测序后的单个细胞的方法,利用了一系列地标基因或空间转录方法的原位杂交产生的高分辨率参考地图集如单胚空间 RNA 测序。后一种技术已经在与 Lescroart 等人的工作重叠的阶段中被开发出来,且应该允许这个新数据集的拓扑映射。这将允许在不同的轨迹上识别出对原始细胞的定位,并阐明我们对心脏和心脏细胞类型的未来区域是如何在祖细胞群中形成模式的理解。
这种高通量数据集的另一个挑战在于从无数实验中筛选出有效的数据,对额外的细胞和时间点的分析可能会干扰我们对祖细胞结构的看法。将单细胞转录组方法与单细胞表观基因组数据集和谱系相结合,能够提供一个动态心血管祖细胞景观的细粒度图谱,指导我们对在发展和疾病中驱动心脏祖细胞命运的选择机制的系统探索。
参考资料:Diverging roads to the heart
文章来源:生物360



{replyUser1} 回复 {replyUser2}:{content}