最好的假日礼物!FDA连批三款新药

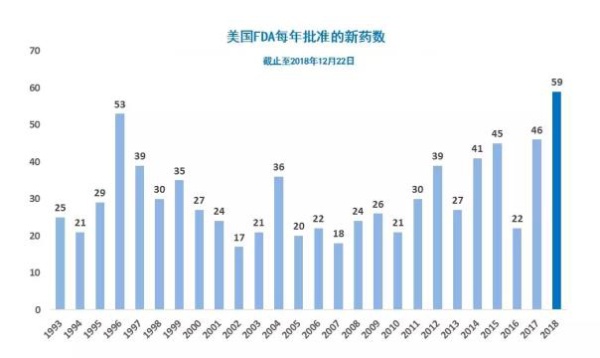
2018年即将迎来尾声。在迎接2019年的喜庆氛围中,FDA为即将进入假期的患者们送来了最好的假日礼物。这两天,美国FDA连批3款新药上市,将本年度获批新药数目提升到59款。下面我们来看看这三款新药将为哪些患者造福:
治疗罕见血癌的第一款疗法
第一款新药是来自Stemline Therapeutics公司的Elzonris (tagraxofusp-erzs),它获批用于治疗2岁以上的母细胞性浆细胞样树突细胞肿瘤(BPDCN)患者。
BPDCN是一种侵袭性强的罕见骨髓和血液疾病,它影响多种器官,包括淋巴结和皮肤。它通常以白血病的形式出现或者会演变为急性白血病。这一疾病在男性中更为常见,在60岁以上人群中发病率更高。
Elzonris是Stemline公司开发的靶向IL-3Rα(CD123)的靶向疗法。IL-3R是在BPDCN细胞和多种其它血癌细胞上高度表达的蛋白。Elzonris将人源化的重组IL-3蛋白与白喉毒素连接在一起。IL-3 片段能够将具有细胞毒性的白喉毒素片段运送到表达IL-3R的肿瘤细胞内。进入细胞后,Elzonris能够不可逆地抑制蛋白合成,从而引发靶标细胞的细胞凋亡。它曾经获得FDA授予的突破性疗法认定,孤儿药资格和优先审评资格。
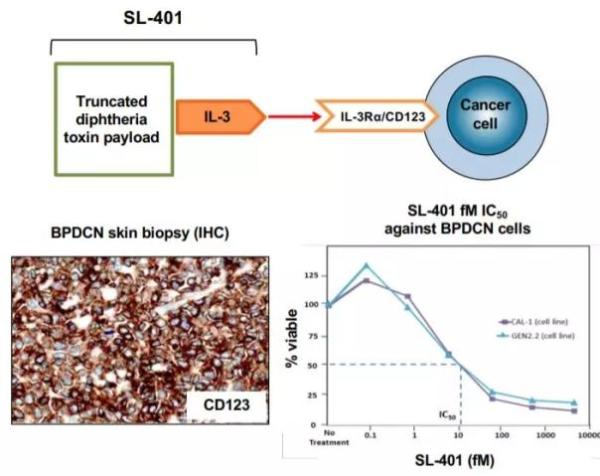
▲Elzonris(SL-401)作用机制(图片来源:Stemline公司官网)
这一批准是基于Elzonris在一项单臂临床试验中的表现。在这项试验中,第一个队列的患者为13名未接受过治疗的BPDCN患者,其中7名(54%)患者达到完全缓解(CR)或者完全缓解,并且皮肤上的异常并不代表活跃疾病(CRc)。第二个队列的患者为15名复发/难治性BPDCN患者,其中1名患者达到CR,另有一名患者达到CRc。
“在今日的批准之前,BPDCN患者没有FDA批准的疗法,对他们的标准疗法是强力化疗,随后是骨髓移植手术。很多BPDCN患者无法耐受强力化疗,因此他们急需替代治疗选择。”FDA肿瘤卓越中心主任Richard Pazdur博士说。
改变罕见血液疾病治疗模式的新疗法
FDA批准的第二款新药是Alexion Pharmaceuticals公司开发的Ultomiris (ravulizumab),用于治疗阵发性睡眠性血红蛋白尿(PNH),这是一种危及生命的罕见血液疾病。FDA原定在2019年2月18日之前对Ultomiris的申请做出决定,这一批准比预计时间提前了两个月。
PNH是一种罕见血液疾病,它导致患者血红细胞破裂和毁坏(又称为溶血)。PNH患者缺乏保护血红细胞不被自身免疫系统损坏的特定蛋白。这些患者可能由于身体的应激反应突然出现疾病发作,血红细胞会被过早毁坏,导致感染或脱力。这种疾病发作可以重复出现。发病时,患者的其它症状包括:严重贫血、非常疲惫、呼吸急促,血尿、肾病和重复出现的疼痛。
Ultomiris是一种长效补体抑制剂,它可以抑制补体级联反应中的C5蛋白,从而防止溶血的发生。患者只需要每8周接受一次注射就可以控制病情。它曾经获得FDA授予的孤儿药资格和优先审评资格。
这一批准是基于Ultomiris在两项临床试验中的表现。在包含246名未接受过治疗的PNH患者的临床试验中,患者随机接受Ultomiris或eculizumab的治疗。Eculizumab是目前PNH的标准疗法。试验结果表明,Ultomiris与eculizumab相比,达到了非劣效性标准。患者在不接受输血治疗的情况下出现溶血的次数非常相似。
在另一项包含195名患者的临床试验中,接受eculizumab治疗并且症状稳定的PNH患者随机被替换为接受Ultomiris治疗。试验结果表明,Ultomiris与eculizumab相比在这种情况下同样达到了非劣效性标准。
“Ultomiris的批准将改变PNH患者接受治疗的模式,”FDA肿瘤卓越中心主任Richard Pazdur博士说:“此项批准之前,唯一获得批准的PNH疗法需要患者每两周接受一次治疗。这对患者和他们的家庭来说是个重大负担。Ultomiris使用了一种创新配方,患者只需每8周接受一次治疗,而且疗效没有任何减弱。”
治疗急性淋巴性白血病的新方案
第三款新药是由Servier Pharma公司开发的Asparlas(calaspargase pegol-mknl),作为多药化疗组合的一种成分,治疗年龄为1个月至21岁的儿童和青少年急性淋巴性白血病(ALL)患者。
ALL是由于骨髓生成过多未成熟淋巴细胞而导致的血液疾病,它会影响正常血红细胞、白细胞和血小板的生成。化疗组合疗法是治疗ALL的治疗选择之一。化疗组合中的一个常见成分为天冬酰胺酶,它能够将天冬酰胺分解为天冬氨酸和氨。ALL肿瘤细胞自身不能合成天冬酰胺,需要身体中的天冬酰胺才能存活,而健康细胞可以自我合成天冬酰胺。因此,天冬酰胺酶可以通过降低体内天冬酰胺水平,杀伤肿瘤细胞。
Asparlas是一种长效天冬酰胺特异性酶。它将从大肠杆菌中提取的一种天冬酰胺酶进行单甲氧基聚乙二醇修饰。这一新产品与其它天冬酰胺酶相比,能够延长患者在接受两次治疗之间的间隔。它曾经获得FDA授予的孤儿药资格。
这一批准是基于Asparlas在临床试验中表现出的天冬酰胺酶活性,124名B细胞谱系ALL患者接受了包括Asparlas在内的化疗组合疗法的治疗。试验结果表明,每隔3周接受剂量为2500 U/m2静脉注射Asparlas的患者的最低血清天冬酰胺酶活性高于0.1 U/mL。
2018年是丰收的一年。2019年,我们期待同样精彩!
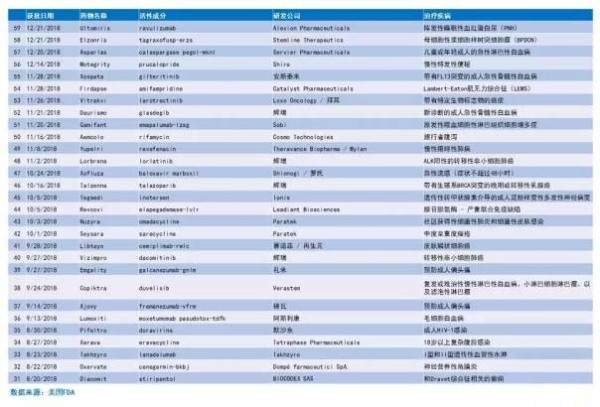
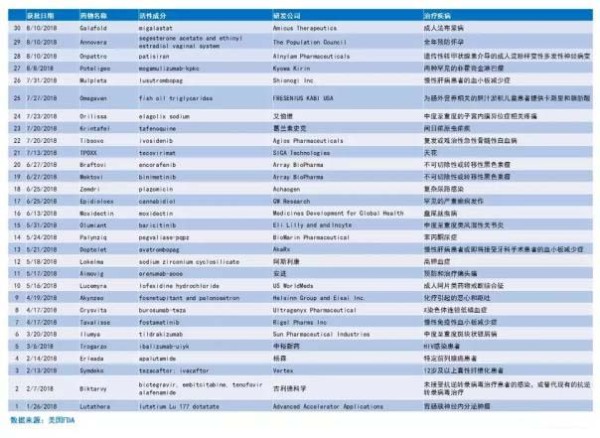
2018年FDA批准新药一览:
参考资料:
[1] FDA approves new treatment for adult patients with rare, life-threatening blood disease
[2] FDA approves first treatment for rare blood disease
[4] FDA Approves Calaspargase Pegol-mknl for Young Patients With ALL
[5] FDA approves longer-acting calaspargase pegol-mknl for ALL
来源:新浪医药
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}