IL-1与自身炎症性疾病:生物学、发病机制和治疗靶点
20世纪70年代,寻找发热的潜在机制中导致一类最初被称为白细胞热原分子的发现。这些分泌蛋白以其触发炎症的效力而闻名,并在20世纪80年代纯化和克隆时最终被命名为IL-1α和IL-1β(图1)。从那时起,这两种独特的炎症介质,都具有共同的IL-1受体(IL-1R1),成为更大的细胞因子IL-1家族的成员,包括11种具有共同无活性前体结构的促炎和抗炎细胞因子以及10种多链细胞因子受体。
IL-1家族还包括两个诱饵受体,一个抑制性结合蛋白和两个受体拮抗剂,其中最广为人知的是IL-1受体拮抗剂(IL-1RA),IL-1R1激活的天然抑制剂。该家族中许多蛋白质的存在,通常具有协同或相反的功能,表明需要严格调控其重要生物学作用。
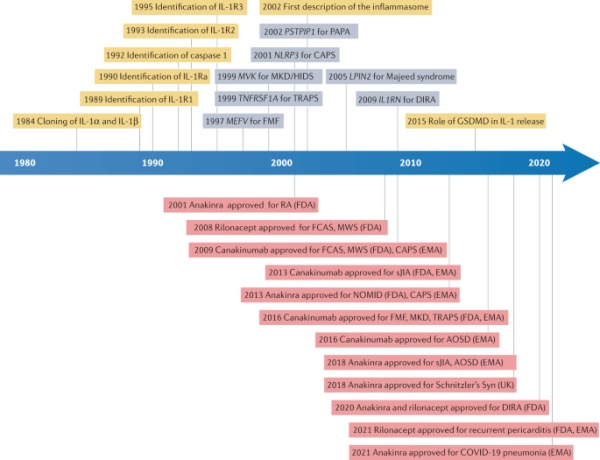
图1:当前了解和治疗IL-1介导的自身炎症性疾病的关键事件的时间表
除发热外,IL-1介导的自身炎症最一致的临床特征是发作性或慢性全身和/或组织炎症。常见受累区域包括皮肤和肌肉骨骼系统,但某些炎症部位是特定IL-1相关疾病所特有的,如浆液膜(胸膜和腹膜)、中枢神经系统(CNS)和结膜。患者还经常主诉疲乏或不适,这是通常与慢性炎症相关的症状。一般而言,在症状期间和发作期间对患者进行的实验室评价显示急性期标志物升高以及血液和组织中的中性粒细胞增多。慢性全身性炎症可导致慢性病贫血和组织损伤,如淀粉样蛋白a淀粉样变性。
IL-1的复杂生物学
IL-1β,常被称为IL-1,主要在骨髓细胞(如单核细胞、巨噬细胞和中性粒细胞)中以高度受控的方式表达,涉及众多的调节机制。IL-1β表达为无活性的前体(IL-1β前体),通过几种蛋白酶裂解为其活性形式,包括半胱天冬酶1以及中性粒细胞和微生物来源的蛋白酶。IL-1β从细胞中释放后,通过与相同细胞或附近细胞上的IL-1R1结合,激活涉及IRAK4、MK2和NF-κB的细胞内信号通路,最终导致炎性细胞因子和炎症小体蛋白的进一步表达,发挥促炎作用。通过这种方式,IL-1β是其自身表达和释放的强效激活剂,导致放大的自身炎症反应。
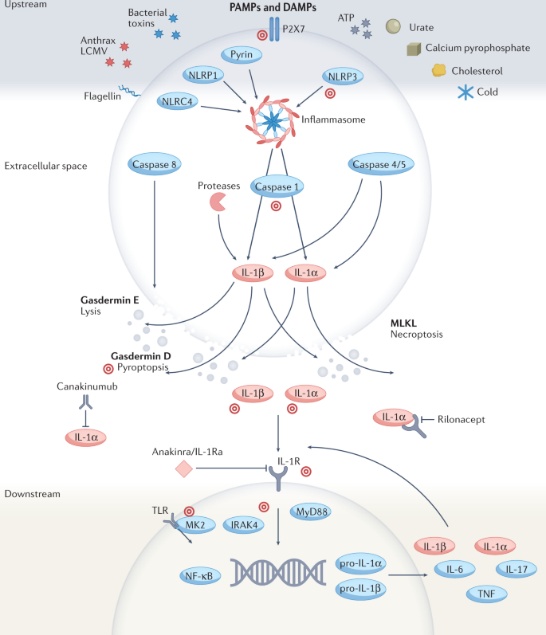
图2:IL-1介导的炎症机制和治疗靶点
IL-1和自身炎症
我们对IL-1生物学复杂性的认识最初源于对发热机制的理解。这些疾病均表现为复发性或慢性全身和组织炎症,合并发热、皮疹和肌肉骨骼症状。鉴定导致这些免疫失调疾病的基因突变导致引入了一种全新的疾病分类,称为自身炎症,其中包括在无高滴度自身抗体或抗原特异性T淋巴细胞的情况下由先天免疫驱动的炎症性疾病。每个发现的自身炎症性疾病都揭示了IL-1生物学失调的新机制,如内在的未调节的炎症小体功能、炎症小体激活的外在机制以及IL-1调节通路无效或缺失。尽管自身炎症的机制超出了IL-1到其他细胞因子和免疫途径,但IL-1介导的自身炎症性疾病的研究仍然是一个令人兴奋的领域。
自身炎症性疾病的病因
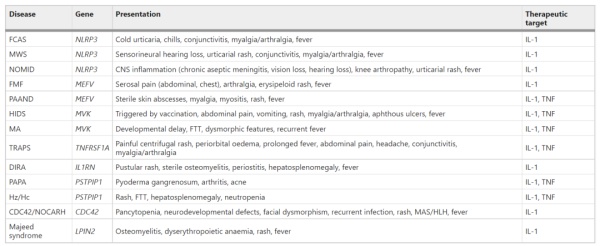
长期以来,自身炎症性疾病的表征与炎症潜在遗传和分子基础的鉴定有关。目前,超过30种基因定义的自身炎症性疾病,许多与IL-1通路有直接和间接联系。单基因自身炎症性疾病是由与炎症控制相关的单个基因突变引起。单基因自身炎症性疾病导致NLPR3或pyrin炎症小体的持续激活和随后半胱天冬酶1的激活,导致IL-1释放和自身炎症。其他单基因疾病,包括由TNFRSF1A、MVK、PSTPIP1和CDC42突变引起的疾病,通过直接炎症小体激活以外的途径导致IL-1激活,例如通过细胞内应激触发因子的积累、增强与已知细胞内感受器的结合或通过影响免疫信号通路。
表1 IL-1驱动的单基因自身炎症性疾病
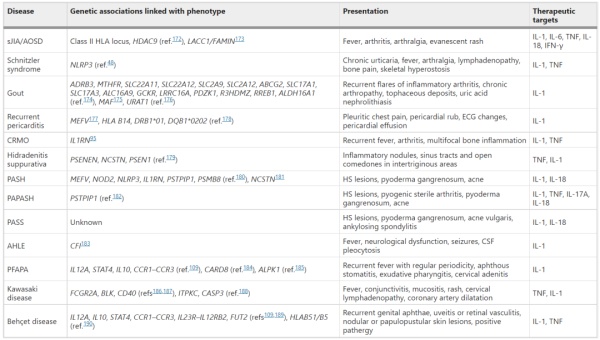
与单基因疾病不同,许多研究通过病例对照研究和IL-1相关通路的全基因组关联研究确定了多种遗传病因。
表2 IL-1作用的多基因自身炎症性疾病总结
治疗自身炎症性疾病
秋水仙碱是最早和应用最广泛的治疗IL-1介导的自身炎症性疾病的药物。FDA于2001年批准IL-1R拮抗剂阿那白滞素用于类风湿性关节炎。此后,又开发并批准了两种IL-1靶向疗法,包括结合并抑制IL-1α、IL-1β和IL-1RA的重组IL-1R利洛那普和特异性结合IL-1β的人源化单克隆抗体canakinumab。所有三种获批的IL-1靶向治疗(补充表2)具有相似的安全性特征,主要不良反应是非机会性感染的风险增加,倾向于轻度,通常可以在不停止治疗的情况下进行治疗。
表3过去十年中开发的靶向IL-1通路的药物
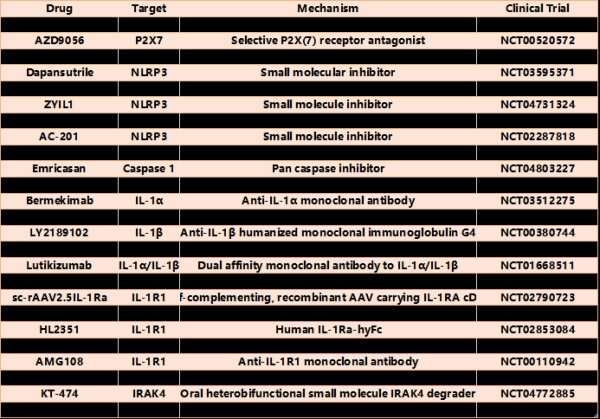
治疗自身炎症性疾病最普遍的小分子靶点一直是NLRP3,从CRID3(现在被称为MCC950)的早期开发开始;再者,目前有多家公司正在开发、收购或研究自己的NLRP3抑制剂用于各种疾病,包括一些单基因自身炎症性疾病。小分子也可以被设计为具有更好的血脑屏障穿透力,这将对具有明显CNS炎症的疾病产生影响。一项研究发现,阻断NLRP3可降低与更广泛IL-1抑制剂相关的特异性感染风险。
靶向炎症小体通路上游和下游的小分子抑制剂同样正在研究中。最早开发的两个通路组分抑制剂是靶向P2X7(负责激活NLRP3的钾通量的ATP的受体)和炎症小体的共同效应酶caspase 1的化合物。除了非IL-1通路功能,P2X7抑制剂可能不会影响内在失调的炎症小体,这些炎症小体可以独立于P2X7被激活。在几种疾病(包括自身炎症性疾病)中开发并研究了特异性半胱天冬酶1抑制剂,但药效学问题和非预期副作用导致其停药。最后,还有其他药物正在开发中,阻断下游IL-1R信号,包括IRAK4和MK2。除了其他细胞因子受体外,抑制这些靶标可能非常有效地阻断IL-1的作用,这可能在适用于其他疾病以及尚不清楚的不良反应方面具有优势和劣势。
来源:生物制药小编


{replyUser1} 回复 {replyUser2}:{content}