CRISPR又出神器 !可显著提高遗传疾病关键基因的编辑效率
自2010年基因编辑工具CRISPR诞生以来,基因工程便掀起了一场革命。2013年,CRISPR首次应用于基因编辑实验。2015年,CRISPR荣登Science杂志十大科学突破榜首。目前,CRISPR在已发表的研究中使用近2000次,其中一些是相关的技术突破。
诚然,CRISPR已经取得了很大的成功,但它并不完美。传统CRISPR-Cas9基因组编辑技术的工作原理是在靶基因处引入双链DNA断裂(DSB)作为基因校正的第一步,然后再利用细胞的自身修复机制进行同源重组修复或非同源末端修复,通常是后者。有研究发现,CRISPR可能会通过这些DSB增加癌症风险,或者引发大量随机插入和缺失。
考虑到细胞DNA修复机制的随机性和脱靶突变的可能,科学家正热衷于开发能以更高精度引入靶向突变的技术,例如单碱基编辑。单碱基编辑不依赖于DSB,至今为止已经可以实现C>T或A>G转换,具有用于纠正或引入单点突变的巨大潜力。
近日,伊利诺伊大学的一个研究团队提出了一种称为CRISPR-SKIP的通用方法,该方法利用胞嘧啶碱基编辑器(CBE)控制基因剪接,实现了靶基因处的外显子跳跃。这意味着,CRISPR-SKIP不仅可以消除突变的基因序列,还能影响基因的表达和调控方式。该研究于8月15日发表在Genome Biology上。

从左到右:伊利诺伊大学Pablo Perez教授,Alan Luu研究生,Jun Song教授和Michael Gapinske研究生(图片来源:firstpost)
胞嘧啶碱基编辑器(CBE)
在了解CRISPR-SKIP策略之前,有必要先来复习下2016年华人科学家David Liu领导的课题组开发的胞嘧啶编辑器(CBE)。

2017年Nature年度人物 David Liu(图片来源:Nature)
该编辑器由dSpCas9与APOBEC1脱氨酶的N末端融合而成,前者含有Asp10Ala和His840Ala突变,使其核酸酶活性失活,但保留了以gRNA引导结合DNA的活性;后者是一种胞嘧啶脱氨酶,可以催化胞嘧啶(C)脱氨生成尿嘧啶(U),之后通过DNA复制或修复尿嘧啶(U)被转换成胸腺嘧啶(T),而最终的结果就是G-C碱基对被成功转换为A-T碱基对。
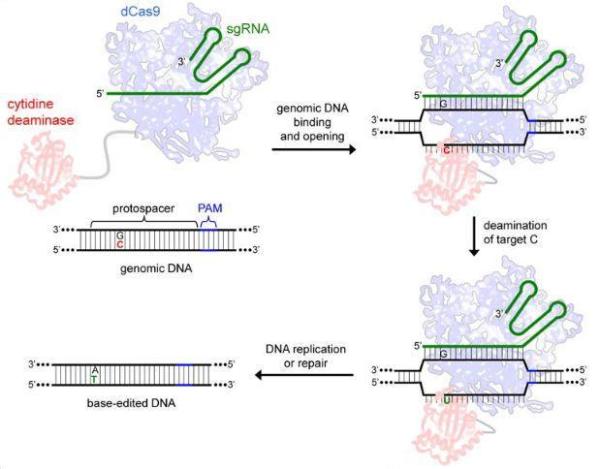
CBE原理(图片来源:Nature)
2017年,该研究组又开发出腺嘌呤碱基编辑器(ABE),将经改造的tRNA腺苷脱氨酶TadA与nSpCas9切口酶融合,实现了DNA中A-T碱基对转换为G-C碱基对。
CRISPR-SKIP策略
基因剪接是真核生物一个关键的生物学过程,前mRNA通过去除内含子序列,使外显子拼接成熟mRNA转录本,然后翻译为蛋白质。简单来讲,外显子就是最终能被编码成蛋白质的基因序列,而内含子不编码蛋白质,但可能起到了基因表达调控的作用。
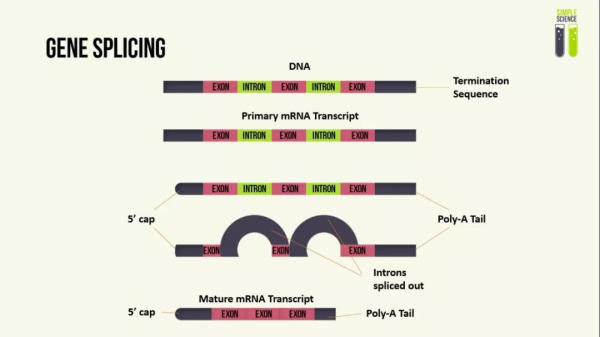
基因剪接示意图(图片来源:YouTube)
在本研究中,CRISPR-SKIP策略旨在将编码蛋白质的某些片段(外显子)标记为空白,然后根据CRISPR-SKIP编辑的DNA指令,在前RNA剪接为成熟RNA时将特定的外显子一同切除。
基因剪接过程中的一个重要步骤是识别定义外显子和内含子的高度保守序列。更具体地说,几乎每个内含子都以鸟嘌呤(G)结束。基于此,研究人员假设在基因组DNA中,通过破坏该鸟嘌呤(*G)的突变能使外显子跳跃,即能够阻止外显子掺入成熟转录物(mRNA)。

CRISPR-SKIP策略(A:剪接体的共有序列。假设高度保守的*G的编辑能导致外显子跳跃;B:利用CBE实现G-C到A-T的转换)
Perez-Pinera教授说:“虽然跳过外显子会导致缺少少量氨基酸的蛋白质,但所产生的截短蛋白质通常会保留部分或完全活性,这可能足以恢复某些遗传性疾病的功能。例如,在Duchenne肌营养不良症中,仅仅修正5%至10%的细胞就足以获得治疗效果。而我们使用CRISPR-SKIP在许多细胞系中都获得了超过20%至30%的基因修饰率。”
实验结果
研究人员选择了长度为3的倍数的外显子进行研究,以确保外显子跳跃不会产生导致移码突变。首先在胚胎肾细胞系293T中进行了测试,他们第一次检测到外显子跳跃是在转染后第4天,而跳跃频率在第6、8和10天显著增加。
结果表明,RELA外显子7和PIK3CA外显子5的跳跃是由C> T碱基编辑诱导的,单独的sgRNA或与dCas9或Cas9-D10A组合不能诱导。通过Sanger测序以及对RT-PCR扩增成熟mRNA的深度测序,证明RELA外显子7和PIK3CA外显子5得到高效的外显子跳跃。

胚胎肾细胞系293T测试结果
此外,针对HCT116、HEPG2和MCF7人类细胞系也进行了CRISPR-SKIP,获得类似的外显子跳跃结果。
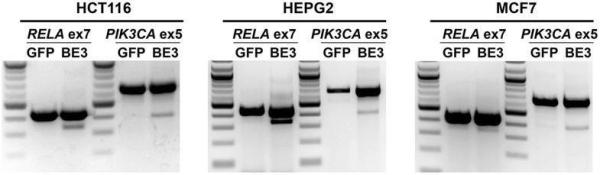
其它几个细胞系也观察到有效的外显子跳跃
接着,研究人员试图将CRISPR-SKIP与当前最先进的外显子跳跃技术进行比较,即SpCas9基因编辑,其依赖于引入DSB来产生随机修复结果,其中一些引起外显子跳跃。针对RELA外显子7,PIK3CA外显子5和JAG1外显子9的情况下,使用CRISPR-SKIP能获得与SpCas9活性相同或更高程度的外显子跳跃。
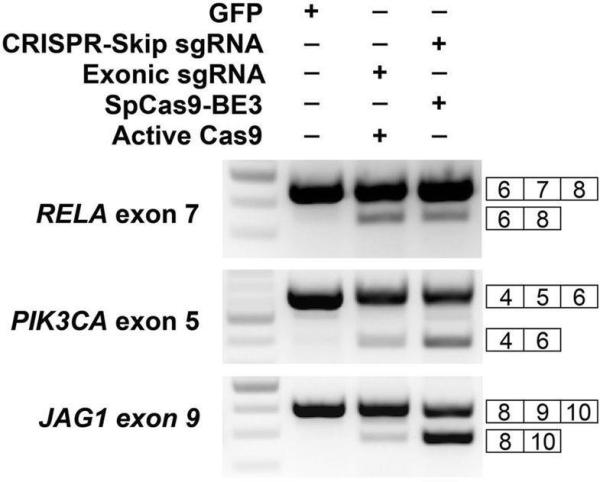
两种技术的对比
为了评估脱靶效应的程度,他们使用18个sgRNA将CRISPR-SKIP靶向16个外显子,并在靶标位点和每个sgRNA的4个高评分脱靶位点进行基因组DNA测序。结果发现,18个sgRNA有14个(77.78%)成功修饰了它们各自的靶标位点,而72个(13.89%)预测的脱靶位点中只有10个显示出修饰的证据。
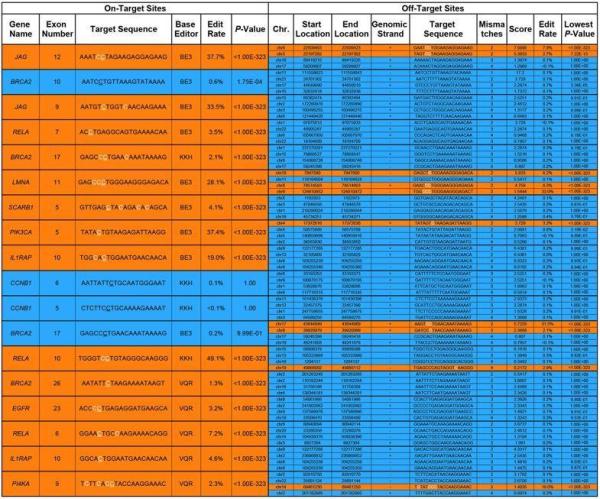
测脱靶修饰分析
此外,使用SpCas9-BE3的CRISPR-SKIP的一个限制是其依赖于位于距靶点12-17bp的PAM位点的存在。但是,并非所有外显子都具有所需范围内的SpCas9-BE3 PAM之一。为了扩展可靶向外显子的数量,研究中还证明使用不同的Cas9构建的单碱基编辑器可识别不同的PAM基序可用于CRISPR-SKIP。
很贴心的是,研究人员开发了一种基于网络的软件工具(http://song.igb.illinois.edu/crispr-skip/),可以快速识别和鉴定给定所需靶基因或外显子的潜在CRISPR-SKIP sgRNA。基于此,他们估计蛋白质编码转录物中187,636个外显子中的118,089个可以被靶向。

CRISPR-SKIP对靶向性的全基因组计算估计
文章共同一作Alan Luu说:“CRISPR-SKIP可永久地敲除外显子,换句话说,单一治疗即可实现对疾病的长期校正,这个过程也是可逆的,同样适用于打开外显子。”
目前研究还处于早期阶段,科学家确实注意到一些基因突变远离了需要最小化的编辑区域。他们下一步将继续研究如何提高CRISPR-SKIP的有效性,像CRISPR-Cas9一样,还必须确保应用于治疗之前技术是安全的。
与其他方法相比,CRISPR-SKIP的一个主要优点是它引入了基因组的变化,只需在外显子之前改变一个碱基,细胞可能会认为它是无用的内含子,并且这些变化是永久性的,不需要DSB来改变基因组DNA。
Song教授说:“我们还没有在体内进行验证,这将是我们的下一步研究计划。”
参考出处:
CRISPR-SKIP: programmable gene splicing with single base editors
Scientists Invent A New Type Of CRISPR That Does Something The Original Can't


{replyUser1} 回复 {replyUser2}:{content}