中科院上海药物所Cell重磅:新突破有望解决癌症治疗困局
最近,素有“诺贝尔风向标”之称的拉斯克奖将“基础医学研究奖”授予了两位在表观遗传学领域做出卓越贡献的科学家C. David Allis教授与Michael Grunstein教授。他们在组蛋白领域做出的突破性贡献不但加深了人类对遗传的理解,还在临床上带来了重要的应用。目前一些抗癌药物背后的机理,正与表观遗传学息息相关。

▲C. David Allis教授(左)与Michael Grunstein教授(右)
(图片来源:Images courtesy of Albert and Mary Lasker Foundation)
在这些药物中,一类叫做EZH2抑制剂的分子受到了新药研发人员的关注。EZH2是PRC2复合体的一部分,参与了组蛋白的甲基化修饰过程,协助抑制基因表达。过去的一些研究发现,如果细胞内的EZH2水平过高,抑癌基因的表达就会得到抑制,提高癌症风险。在实体瘤中,我们经常能看到EZH2的过度活跃。通过抑制EZH2,我们就有望恢复抑癌基因的表达,控制癌症。
不幸的是,尽管人们在EZH2抑制剂的研发上投入了大量时间与金钱,目前EZH2抑制剂的疗效却依然不尽如人意。我们是在哪里做错了吗?

▲这是一项“全华班”的研究(图片来源:《细胞》)
在今日发表于顶尖学术期刊《细胞》的一项研究中,中国科学院上海药物研究所耿美玉课题组、丁健课题组和谭敏佳课题组联合对这一难题进行了攻关,并取得了极为重要的进展。上海药物所的官方新闻称,该研究“极大地拓展了这类抑制剂的临床应用空间”。
那这项突破是怎么完成的呢?首先,研究人员们想要知道,为啥EZH2抑制剂在许多癌症里不管用。他们在83种不同的癌症细胞系里使用了两款已得到验证的EZH2抑制剂EPZ-6438与GSK126,并发现这种疗法是否起效,很大程度上依赖于癌症类型。在血液癌症中,不少细胞系都对药物有所响应;而实体肿瘤的收效则甚微。这与之前的观察一致。
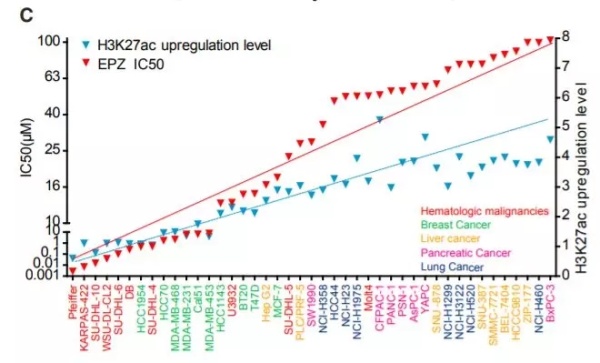
▲H3K27的乙酰化水平与EZH2抑制剂耐药性的关系(图片来源:《细胞》)
进一步的深挖,则发现了两类癌症细胞的不同。在那些对EZH2抑制剂敏感的细胞里,H3K27的乙酰化水平几乎没有明显区别;而在对EZH2抑制剂不敏感的细胞里,H3K27的乙酰化水平有显著上升。这一发现在体内实验中也得到了证实。
也许有不熟悉表观遗传学的读者会问,H3K27究竟是什么意思。它指的是组蛋白H3上的赖氨酸27。EZH2参与的甲基化,作用的正是这个位点。
简单来说,通过这些研究,科学家们了解到H3K27乙酰化状态的改变,可能与EZH2抑制剂的耐受有关。
那么,是什么导致了H3K27位点的甲基化与乙酰化状态的转变呢?在这两类癌细胞中,研究人员们又发现,MLL1蛋白的表达量有显著不同,且其变化看似与EZH2抑制剂引起的H3K27乙酰化状态改变相关。基于这个发现进行的研究,则进一步证实了MLL1在其中的重要作用——当它的水平下调与上调时,H3K227的乙酰化水平也会随之发生下调和上调。
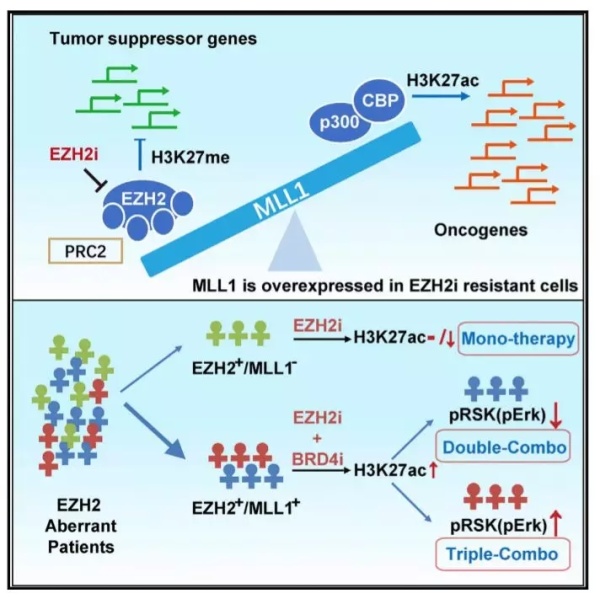
▲本研究的图示(图片来源:《细胞》)
后来,研究人员们通过分析基因表达模式,证明在H3K27乙酰化水平出现上升后,不少致癌通路也得到了激活,这可能导致了EZH2抑制剂的耐受。而同时使用BRD4抑制剂(干扰H3K27乙酰化的识别),则能提高EZH2抑制剂的活性。这在体外与体内实验中,都得到了验证。在一些案例中,这两种药物的组合可以取得高达86.4%的肿瘤抑制率!
但这还不是故事的全部。为了进一步提高这种组合的效果,扩大它们的应用范围,研究人员们进一步寻找在这两类药物作用下,还会出现激活的致癌通路。研究表明,当我们同时抑制H3K27的甲基化和乙酰化,会导致MAPK通路的异常激活。于是,研究人员们设计了一种三重组合疗法,能同时抑制EZH2、BRD4、以及ERK。

▲三重组合疗法(红色)能显著减少肿瘤体积(图片来源:《细胞》)
论文称,这一组合的抗肿瘤效果“令人震惊”。在肝癌模型中,这一组合疗法能将肿瘤抑制率从67.0%提高到99.1%!在肺癌与胰腺癌的模型中,这一组合也取得了类似的惊人效果。
研究人员们指出,这一发现有望带来精准抗癌疗法。根据患者体内特定生物标志物的水平,我们可以因人而异设计疗法,并结合现有的BRD4或/和MAPK通路抑制剂,对他们的难治癌症进行治疗。如果这一思路能在临床试验中得到验证,无疑将是中国科学家为癌症治疗领域做出的重要贡献!
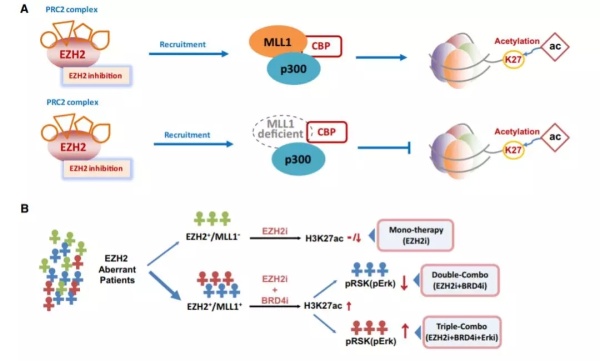
▲本研究有望带来精准抗癌疗法的全新设计(图片来源:《细胞》)
来源:学术经纬
版权及免责声明:本网站所有文章除标明原创外,均来自网络。登载本文的目的为传播行业信息,内容仅供参考,如有侵权请联系答魔删除。文章版权归原作者及原出处所有。本网拥有对此声明的最终解释权。


{replyUser1} 回复 {replyUser2}:{content}