如何利用CRISPR研究癌症:筛选癌症新靶标
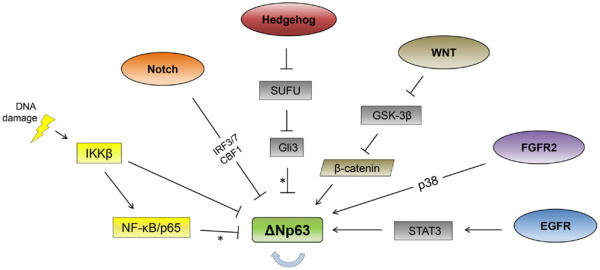
一个小小的p63在胚胎发育过程中具有重要的作用,如果缺失它,就会导致出生缺陷,如cleft palette,手指融合甚至肢体缺失。不过一旦这个早期的工作完成,p63就会回归沉默,从那时起安静地待在基因组中,除非它被意外重新激活。而当p63在成人基因组中重新被激活时,结果可能是癌症,之前的研究发现皮肤,肺,乳房和头颈部发现的所有鳞状细胞癌中有超过一半的出现了过量p63活性。
因此科学家们已经知道了p63可以驱动鳞状细胞癌,但问题是如何处理它。因为简单地关闭p63当然是不可能的,如何能干扰p63的作用,保护患者免受癌症影响,这才是问题的关键。
来自美国科罗拉多大学癌症中心的Joaquin Espinosa博士带领其研究组揭示了肺鳞状细胞癌中p63的活性,为这种已知的癌症病因提供了可行的药物开发途径。
这一研究发表在9月18日的Cell Reports杂志上。
Espinosa博士表示:“启动这项研究的关键问题是这个致癌基因p63是什么,它如何促进细胞增殖,以及为什么过量会导致癌症。”
为了回答这个问题,Espinosa及文章第一作者Christopher Abraham博士,利用CU癌症中心功能基因组学共享资源,通过全基因组CRISPR筛选细胞,CRISPR是一种能够在一个实验分析数千种基因的尖端技术,研究人员构建了肺鳞状细胞癌细胞,表达p63基因的致癌产物,即称为Np63a的蛋白质,之后他们关闭了这些细胞中Np63a的表达。
“这是癌基因和抑癌基因之间经典拉锯战的一个例子,基于这种平衡,你要么患上癌症,要么不会患上癌症,”Espinosa说。
为了鉴定这些与Np63a发生对抗的抑癌基因,研究人员利用CRISPR筛选关闭基因组中的数千个基因,寻找哪些基因在灭活后会令这些癌细胞重新开始生长。
“我们筛选了整个基因组,从中发现了一个分子途径,”Espinosa说。
这个途径中的关键抑癌基因是TGFB2和RHOA。当研究人员在518份肺鳞状细胞癌样本的已发表数据中查看癌症基因组图谱时,他们发现在活化Np63a的癌症中,约80%也显示出灭活的TGFB2和RHOA。
“Np63a关闭TGFB2和RHOA以促进癌症进展,这显然是鳞状细胞癌中普遍存在的现象,”Espinosa说。
因此针对Np63a的治疗途径也很清楚了——激活TGFB2和RHOA。
“如果有办法提供模拟TGFB2的东西,也许我们可以阻止鳞状细胞癌的扩散,”Espinosa说。
“这是一种潜在的可药物通路,正在推动鳞状细胞癌的临床发展,”Espinosa说,“现在的挑战是利用这些知识进行治疗,找到一种方法来重新激活TGFB/RHOA途径,挽救癌症患者的生命。”


{replyUser1} 回复 {replyUser2}:{content}