根据PDUFA的预期目标日期,预计1月,美国FDA将对2款创新药物的批准做出监管决定。与此同时,行业媒体BioSpace也公布了今年第一季度,美国FDA备受瞩目的5项监管决定。药明康德内容团队今日便根据公开资料,针对这些疗法进行相关介绍。
▲1月美国FDA可能批准的新药(图表来源:药明康德内容团队制图)
由Novan所研发的10.3% berdazimer凝胶(SB206)是一种用于治疗病毒性皮肤感染的局部抗病毒凝胶,有望成为治疗软疣的“first-in-class”局部治疗药物。该产品的活性成分berdazimer是一种新化学实体(NCE),可释放一氧化氮(NO),具有抗病毒活性。在一项名为B-SIMPLE4的关键3期临床研究中,研究人员评估了berdazimer治疗软疣的安全性和疗效。结果显示,研究主要终点达到了统计学意义的显著改善(p<0.001),患者经过12周治疗后实现了病灶完全清除。同时,研究显示该疗法具有良好的安全性,没有报告药物相关严重不良事件。Zolbetuximab是一种IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合从而发挥抗肿瘤作用。临床前研究表明,这种结合作用通过激活两种不同的免疫系统途径——抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)诱导癌细胞死亡,以期达到肿瘤治疗的目的。Zolbetuximab作为CLDN18.2阳性局部晚期不可切除或转移性HER2阴性胃或胃食管结合部(GEJ)腺癌患者的一线治疗已获得FDA授予其优先审评资格。去年1月,安斯泰来公布的SPOTLIGHT试验结果显示,与接受安慰剂加上mFOLFOX6化疗方案的患者相比,接受zolbetuximab与mFOLFOX6化疗方案组合治疗患者的无进展生存期(PFS)与总生存期(OS)在统计上有明显改善。与安慰剂组相比,试验组患者的疾病进展与死亡风险显著降低24.9%,达成试验主要终点。接受zolbetuximab组合治疗的患者中位无进展生存期为10.61个月(vs 8.67个月),总生存期也获得延长,中位总生存期为18.23个月(vs 15.54个月)。两组患者发生严重治疗伴发不良反应的比率相似,分别为44.8%与43.5%,此观察与之前试验结果一致。公司:Iovance BiotherapeuticsLifileucel是基于患者自身的肿瘤浸润淋巴细胞(TIL)构建的细胞疗法,这些TIL在癌症发生时会迁移到肿瘤处并且对肿瘤发起攻击。然而,通常患者体内的TIL数目不足以消灭肿瘤,而且肿瘤微环境会抑制TIL的功能。这款疗法通过从患者体内获取肿瘤组织并且提取TIL,然后在体外使用IL-2细胞因子刺激TIL的扩增。这一体外刺激手段不但增加了TIL的数量,还能激活TIL的抗肿瘤能力。然后这些TIL被注回患者体内,更有效地杀伤肿瘤细胞。临床试验结果表明,一次性注射lifileucel,能够在接受过PD-1抑制剂和BRAF/MEK靶向疗法的难治性黑色素瘤患者中,达到34.3%的总缓解率。如果获批,它不仅将成为首款问世的TIL疗法,也将成为首款获批治疗实体瘤的T细胞疗法,有望成为细胞疗法的又一里程碑。
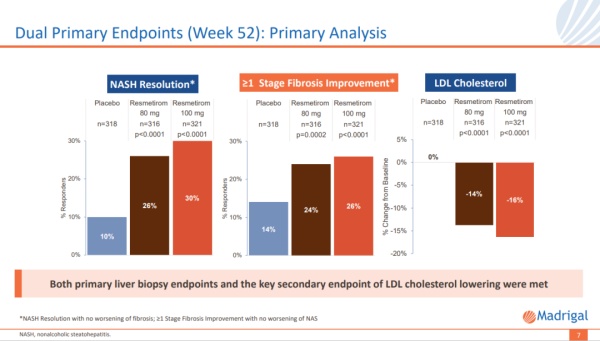
精神分裂症是一种慢性的精神疾病,会影响患者如何思考、感觉和行动。此病包含阳性症状(幻觉、妄想)、阴性症状(难以享受生活、脱离人群)以及认知障碍。Roluperidone是一种在研小分子拮抗剂,开发用以治疗精神分裂症的阴性症状。该疗法已被证明可以阻断血清素、sigma和α-肾上腺素能受体,这些受体都参与调节重要的大脑功能,包括情绪、认知、睡眠和焦虑。Roluperidone旨在避免直接阻断多巴胺能受体(第一代和第二代抗精神病药的关键药理学靶点),同时保持对血清素受体的特定亚型5-HT2A(第二代抗精神病药的另一个关键靶点)以及其他药理学靶点(sigma2和肾上腺素-α1A)的阻断。GA Depot是Mapi Pharma公司旗下已获批上市药物醋酸格拉替雷的长效注射制剂(商品名Copaxone),用药方案为每四周进行一次肌肉注射,共计13次注射,用于治疗复发型多发性硬化(RMS)。临床3期试验结果显示,该研究达到了主要终点,与安慰剂对照组相比,GA Depot治疗组患者的年复发率显著降低了30.1%。公司:Madrigal PharmaceuticalsResmetirom是一种每日一次、口服、甲状腺激素受体(THR)-β选择性激动剂,旨在靶向非酒精性脂肪性肝炎(NASH)的关键基础病因。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇和甘油三酯水平,到肝脏中脂肪病理性积聚等一系列健康参数。Resmetirom具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并且在肝脏部位被特异性摄取。临床试验中,绝大多数(>70%)接受100 mg resmetirom治疗的患者达成≥30%的质子密度脂肪分数(MRI-PDFF)缓解。值得注意的是,≥30%MRI-PDFF的降低与NASH缓解(96%的患者)和纤维化改善(88%的患者)密切相关。2023年9月,美国FDA授予该疗法治疗NASH的优先审评资格。▲MAESTRO-NASH试验疗效结果(图片来源:参考资料[2])
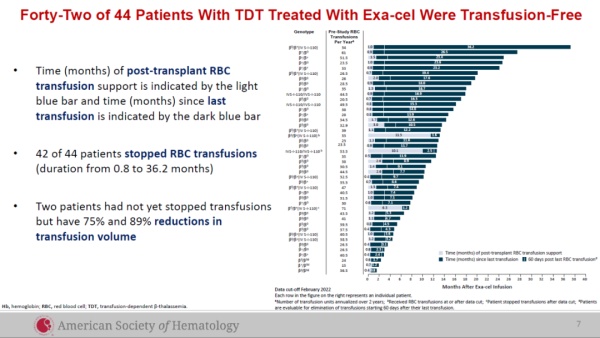
疗法:Casgevy(exagamglogene autotemcel,exa-cel)公司:Vertex Pharmaceuticals & CRISPR TherapeuticsCasgevy在去年12月8日获FDA批准用以治疗12岁及以上患有复发性血管闭塞危象的镰刀型细胞贫血病(SCD)患者,这是FDA批准的首款CRISPR基因编辑疗法。然而FDA仍在审评该疗法用以治疗输血依赖性β地中海贫血(TDT)患者的申请,并预计在3月30日前公布审评结果。2023年11月,英国药品和健康产品管理局(MHRA)已授予Casgevy有条件上市许可,用于治疗SCD以及TDT患者。而根据Vertex的公告,Casgevy在去年12月获欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐用以治疗这两种疾病,EMA预计将于2月份就这两个适应症做出最终监管决定。Casgevy用以治疗TDT患者的全球临床试验中达到了主要终点,在接受治疗的44名TDT患者中,42名在随访时间为1.2-37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。▲接受exa-cel治疗的TDT患者的临床试验数据(图片来源:CRISPR Therapeutics公司官网)




{replyUser1} 回复 {replyUser2}:{content}