|
2024-05-08 07:20:19
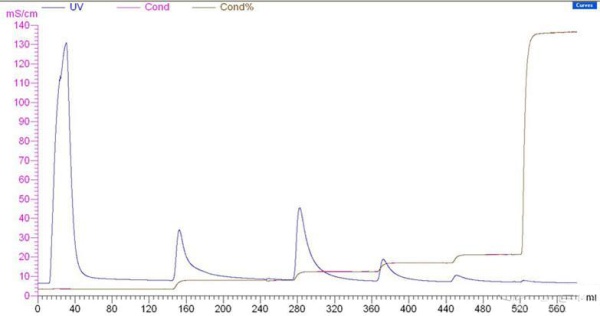
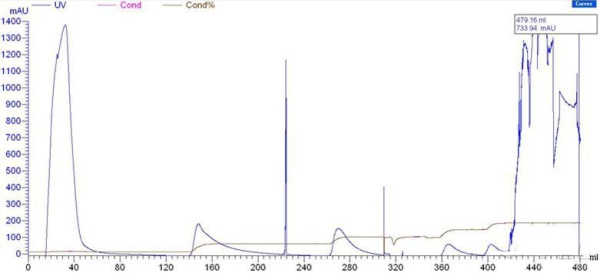
怎样提高目标蛋白吸附到DEAE-Sephrose Fast Flow介质的量纯化人血浆中的一种蛋白,分子量52kDa,等电点4.55,前处理采用还原剂打断杂蛋白的二硫键(不影响目标蛋白),气相二氧化硅吸附脂蛋白。上柱子前的蛋白含量为7mg/ml,平衡液为50mM pH 7.5的Tris,在平衡液中增加NaCl盐浓度0.05M、0.1M、0.15M、0.2M梯度洗脱,通过活性测定和SDS-PAGE电泳发现0.05NaCl洗脱杂蛋白,0.1MNaCl洗脱目标蛋白。 存在的问题是未结合在介质上峰很大,里面也有不少目标蛋白,活性比0.1MNaCl洗脱峰的活性还高。 我已经尝试提高平衡液的pH到8.0,其余都不变,效果还不如原来,未结合峰的活性更大。该怎样改变条件才能提高目标蛋白在介质上的结合量呢?求各位前辈指点迷津,感激不尽。 以下是我的AKTA层析图谱,第一个是pH 7.5,第二个是pH8.0
这五个峰分别是未结合(峰很高)、0.05M、0.1M、0.15M、0.2MNaCl洗脱 这五个峰分别是未结合(峰很高)、0.05M、0.1M、0.15M、0.2MNaCl洗脱,后面是机器不稳定造成的峰
|
3个回答
|
不知楼主的纯化目标是什么?是只想得到较纯的目的蛋白做分析呢?纯度有何要求?还是需要优化工艺提高收率和分辨率?如果是后者,选择一个合适的填料是首要的,主要考察其结合能力、分辨率,可尝试一下强阴的Q;其次是筛选一个合适的上样条件,离子交换也就是筛选合适的上样pH,阴离子结合洗脱模式一般高于等电点0.5个pH以上,当然要注意上样时电导率低一些(一般<5 mS/cm);在填料和上样条件确定的情况下,就要去测你目的蛋白的动态结合载量(DBC),这样,你才能确定你的上样量,避免流穿;洗脱可用线性梯度洗脱来提高分辨率和收率,再由线性洗脱条件转化为阶梯洗脱,以节约时间和Buffer。根据你的情况,建议降低上样量,看是否还会有流穿,用盐浓度线性梯度洗脱,0-20%B (1 M NaCl),20 CV,分管收集看主要成分在哪里。 |
|
首先介质本有自己性能,即自身的动态载量,这个载量会随着样品的性质发生改变,也会随流速改变。有较大的穿透,证明在该条件下已达到你的动态载量。 我个人介意从以下几个方面入手:1、降低平衡液电导与样品电导。之前你用还原剂,样品中电导值必然会比较高。通过稀释降低电导值。2、提高上样pH,你也尝试了,可以进一步探索,在保证蛋白性质不改变情况下。3、降低流速,高流速下,结合性能下降。3、更换介质,DEAE属于弱阴离子交换,可以换成强阴离子试试。你的基架,琼脂糖的,可以换成其他种类,推荐你可以试试 ABI的POROS Q。 |
|
1、透析或者用超滤离心管换液至平衡缓冲液,可以有效降低样品电导值。2、既然pH你已经做过实验了,影响不大,那平衡液的电导值呢? 50mM的浓度你是怎么得来了,一般都会产用20mM作为起始离子强度,若结合效果好,可再进一步优化。既然你为了保证不穿透,可以尝试降低你的平衡液浓度,10mM 20mM均可。3、 流速,你给我的是体积流速,你柱子是多少尺寸的,你可以自己换算下,推荐线性流速100cm/h时,看有木有增加你的结合量。4、缓冲液阴离子一般就用Tris 其PK大概在8.0左右,缓冲效果好,无需更换成PB。 |
你的回答
| 提问时间: | 2024-05-08 |
| 浏览量: | 4115 |
| 最近回答: | 2024-05-08 |